
【题目】(1)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全剂而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。制备ClO2有下列两种方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
方法一
① 氧化剂 、氧化产物 、
②氧化剂与还原剂物质的量比 。
③用双线桥法标明电子转移的方向和数目
方法二
④被氧化的物质是 ________
⑤若反应中有0.1 mol电子转移,则产生的ClO2气体在标准状况下的体积为________L;
(2)某无色透明溶液与金属铝反应放出H2,试判断下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、HCO3-、OH-、NO3-哪些能大量共存。
⑥当生成Al3+ 时,可能存在 _。
⑦当生成AlO2- 时,可能存在 _。
【答案】
(1)① NaClO3;Cl2;②1 :1;
③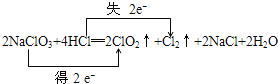 ;④ H2O2;⑤ 2.24;
;④ H2O2;⑤ 2.24;
(2) ⑥Mg2+;⑦NO3-。
【解析】
试题分析:(1)①化合价升高元素Cl所在的反应物HCl是还原剂,对应产物Cl2是氧化产物;化合价降低Cl元素所在的反应物NaClO3是氧化剂,所在的产物ClO2是还原产物;故答案为:NaClO3; Cl2;
②化合价升高元素所在的反应物HCl是还原剂,4mol盐酸参加反应,一半做还原剂,化合价降低Cl元素所在的反应物NaClO3是氧化剂,氧化剂与还原剂物质的量比是1:1,故答案为:1:1;
③反应2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O中,化合价升高元素Cl所在的反应物HCl,是还原剂,合价降低Cl元素所在的反应物NaClO3是氧化剂,化合价降低值=化合价升高值=转移电子数=2,电子转移如下: ,故答案为:
,故答案为: ;
;
④化合价升高的元素是H2O2中的O元素在反应中被氧化,故答案为:H2O2;
⑤反应2NaClO3+H2O2+H2SO4═2ClO2↑+O2↑+Na2SO4+2H2O中,有2mol电子转移,则产生的ClO2气体2mol,若反应中有0.1mol电子转移,则产生的ClO2气体0.1mol,在标准状况下的体积为0.1mol×22.4L/mol=2.24L,故答案为:2.24。
(2)溶液无色,则一定不存在Cu2+离子;与金属铝反应放出H2,该溶液为酸性或强碱性溶液。
⑥当生成Al3+时,说明溶液呈酸性,一定存在:H+,一定不存在:HCO3-、OH-,因在含HNO3的溶液中放入Al不生成H2,则一定不存在NO3-离子,酸性溶液中不存在HCO3-、OH-离子,根据溶液电荷守恒,则溶液中一定存在阴离子,即SO42-离子一定存在,而Ba2+、Ag+与SO42-离子生成难溶或微溶于水的沉淀,则一定不存在Ba2+、Ag+离子,则可能大量存在Mg2+,故答案为:Mg2+;
⑦当生成AlO2-时,说明溶液呈碱性,溶液中存在大量的OH-离子,与OH-离子反应的Mg2+、Cu2+、H+、Ag+、HCO3-离子不能大量存在,根据溶液电荷守恒,则溶液中一定存在阳离子,即Ba2+离子一定存在,而Ba2+与SO42-离子生成难溶于水的沉淀,则一定不存在SO42-离子,则一定大量存在OH-、Ba2+,可能存在NO3-,故答案为:NO3-。


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图装置进行“铁与水反应”的实验(加持装置已略去),并检验产物的性质,请回答下列问题
(1)A装置的作用是________________,烧瓶底部放碎瓷片的作用是___________________。
(2)写出装置B中发生反应的化学方程式:______________。
(3)D的作用是___________________。
(4)E中的实验现象是________。
(5)A、B两个装置中应先点燃________处的酒精(喷)灯,点燃E处酒精灯之前应进行的操作是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法正确的是
A. 汽油不完全燃烧产生的氮氧化物是引起硝酸型酸雨的主要原因
B. 日常生活中,卤水点豆腐、花生中提取花生油、海水晒盐都是物理变化
C. 制肥皂时,在皂化液里加入饱和食盐水,不能促进高级脂肪酸钠的析出
D. 铝比铁活泼,所以一般情况下,铁制品比铝制品更耐腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将m g含氧化铁、氧化铜和氧化亚铁的样品投入物质的量浓度为1 mol/L的2 L盐酸中恰好完全反应,若向等质量的该样品中通入足量的氢气并加热,充分反应后所得金属的质量是( )
A.(m-16)g B.(m+16)g C.(m-32 )g D.16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4 ℃时,若20滴水恰好为1 mL,那么1滴水中所含的水分子数约为(NA表示阿伏加德罗常数的值)( )
A. 20NA B. NA/360 C. 9NA/10 D. 360/NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X是空气的主要组成元素, X与Y同族。下列说法正确的是
A. 原子半径:W<X<Y<Z
B. 气态氢化物的热稳定性:Z<Y
C. W与X 组成的化合物都易溶于水
D. 最离价氧化的水化物的酸性:Z>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z、M的原子序数依次增大,元素W的一种核素的中子数为0,X的原子最外层电子数是次外层的2倍,Z与M同主族,Z2-电子层结构与氖相同。
(1)M位于元素周期表中第_________周期_________族。
(2)化合物p由W、X、Y、M四种元素组成,已知向p溶液中加入FeCl3溶液,溶液变血红色;向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体。p的化学式为_________。
(3)用X、Y、Z三种元素可组成可组成摩尔质量为84g·mol-1的q,且q分子中三种元素的原子个数之比为1:1:1。已知q分子中个原子均达到8电子稳定结构,且分子中不含双键,但含极性键和非极性键,q分子的结构式为_________。
(4)(XY)2的性质与Cl2相似,(XY)2与NaOH溶液反应的离子方程式为_________。
(5)常温下,1molZ3能与Y的最简单氢化物反应,生成一种常见的盐和1molZ2,该反应的化学方程式
为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com