
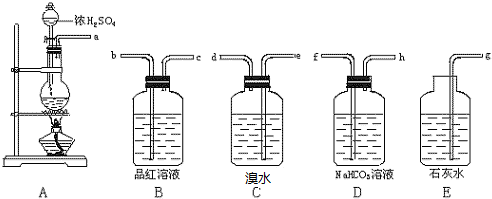
分析 (1)二氧化硫和二氧化碳都能够使澄清石灰水变浑浊,所以检验二氧化碳前需要先除尽二氧化硫,据此连接装置;
(2)装置B中盛放的是品红溶液,二氧化硫能够使品红溶液褪色,需要用品红溶液检查SO2是否除尽;
(3)溴水能够将二氧化硫氧化成硫酸和溴化氢,据此写出反应的化学方程式;
(4)二氧化硫能够与碳酸氢钠反应生成二氧化碳,对检验二氧化碳带来干扰;
(5)装置E中澄清石灰水与二氧化碳反应生成碳酸钙沉淀和水.
解答 解:(1)碳与浓硫酸反应生成二氧化碳和二氧化硫气体,由于二者都能够使澄清石灰水变浑浊,所以检验二氧化碳前需要先用溴水或酸性高锰酸钾溶液除去二氧化硫,然后用品红溶液检验二氧化硫已经除尽,最后用澄清石灰水检验二氧化碳,所以装置连接顺序为:A→C→B→E,
故答案为:C→B;
(2)需要除尽混合气体中的二氧化硫后再检验二氧化碳,所以需要用品红溶液检验二氧化硫是否除尽,
故答案为:检查SO2是否除尽;
(3)装置C中的溴水能够氧化二氧化硫,反应的方程式为:Br2+SO2+2H2O=H2SO4+2HCl,从而排除二氧化硫对检验二氧化碳的干扰,
故答案为:Br2+SO2+2H2O=H2SO4+2HCl;
(4)由于碳酸氢钠与二氧化硫发生反应:SO2+NaHCO3═NaHSO3+CO2,产生的二氧化碳干扰了二氧化碳的检验,所以不能选用装置D,
故答案为:否;SO2会与NaHCO3反应产生CO2,干扰CO2的检验;
(5)二氧化碳与澄清石灰水反应生成碳酸钙沉淀,装置E中盛放的是澄清石灰水,用于检验二氧化碳气体,反应的离子方程式为:CO2+Ca2++2OH-=CaCO3↓+H2O,
故答案为:CO2+Ca2++2OH-=CaCO3↓+H2O.
点评 本题考查了浓硫酸的性质、性质实验方案的设计,题目难度中等,明确二氧化碳、二氧化硫的性质及检验的先后顺序为解答关键,注意掌握浓硫酸的化学性质,试题培养了学生灵活应用基础知识的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | -218 kJ/mol | B. | -109 kJ/mol | C. | +218 kJ/mol | D. | +109 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Fe | 稀盐酸 | 偏向Fe |
| 2 | Fe、Cu | CuSO4溶液 | 偏向Cu |
| 3 | Fe、石墨 | 稀盐酸 | ? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1丙醇 | B. | 乙醇 | C. | 1丁醇 | D. | 1戊醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 过氧化氢是应用广泛的“绿色”氧化剂,酸性条件下稳定,中性或弱碱性条件下易分解.填空:
过氧化氢是应用广泛的“绿色”氧化剂,酸性条件下稳定,中性或弱碱性条件下易分解.填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学键的类型由元素的类别决定 | |
| B. | 不同种元素组成的多原子分子里的化学键一定是极性键 | |
| C. | 阴、阳离子相互反应形成的化学键称为离子键 | |
| D. | 熔融态下能导电的化合物中一定含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com