
【题目】白黎芦醇具有抗氧化和预防心血管疾病的作用,下列有关白黎芦醇的说法正确的是
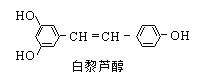
A.白黎芦醇能与NaHCO3溶液反应
B.分子中共含有8种化学环境不同的氢原子
C.1 mol白黎芦醇最多能与7 mol氢气加成
D.1 mol白黎芦醇最多能反应溴水中的3.5 molBr2
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:
【题目】向X溶液中缓慢滴加Y溶液,生成沉淀的质量如图所示,符合图像的一组是

X | Y | |
A | AlCl3、Mg(NO3)2、HNO3 | NaOH |
B | Na2CO3、NH4HCO3、Na2SO4 | Ba(OH)2 |
C | NH4NO3、Al(NO3)3、Fe(NO3)3、HCl | NaOH |
D | NaAlO2、氨水、NaOH | H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)分别向盛有等量铜片的四支试管中加入等体积的①浓硫酸;②稀硫酸;③浓硝酸;④稀硝酸,能随即发生剧烈反应的是(填序号,下同)____________,常温下缓慢反应(或微热后能发生剧烈反应)的是____________,常温下不反应,但加热后发生剧烈反应的是____________,加热也不发生反应的是____________。由此可以得到上述四种酸氧化性由强到弱的顺序是____________。
(2)先将铜与浓硫酸加热时反应产生的气体X持续通入如图装置中,一段时间后再将铜与浓硝酸反应产生的大量气体Y也持续通入该装置中,可观察到的现象包括____________。
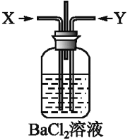
A.通入X气体后产生白色沉淀
B.通入X气体后溶液中无明显现象
C.通入Y气体后开始沉淀
D.通入Y气体后沉淀溶解
E.通入Y气体后溶液中无明显现象
由此可得到的结论是____________。
A.HNO3的酸性比H2SO4的强
B.盐酸的酸性比H2SO3的强
C.BaSO3能溶于盐酸
D.HNO3能氧化H2SO3(或SO2)
E.BaSO4不溶于水也不溶于HNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B ![]() 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A. v(A)=0.5mol·L-1· s-1B. v(B)=0.3 mol·L-1· s-1
C. v(C)=0.8 mol·L-1· s-1D. v(D)=10 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 
D. H2O的电子式: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的五种前四周期元素。A的核外电子总数与其周期数相同;B的价电子排布式为nsnnpn+2;短周期元素C和D为同周期不相邻的元素,C是同周期元素中离子半径最小的元素,D元素最外层有两个未成对电子;E位于元素周期表的第四周期第IVB族,常用加热ECl4(氯化物)溶液的方法制备纳米材料。回答下列问题:
(1)D元素在周期表中的位置为______,E原子核外有_____个未成对电子,五种元素中电负性最大的是_____(填元素名称)。
(2)由A、B、D三种元素形成的常见三元化合物中具有强氧化性的是______(填化学式)。
(3)氯元素能与C(非碳元素符号)形成某化合物Q。在1.01×105Pa、T1℃时,气体摩尔体积为53.4L/mol,实验测得Q的气态密度为5.00g/L,则此时Q的结构式为___________。(如有配位键须用“→”标出)
(4)A、B、D元素形成的化合物有A2B、DB3,下列关于A2B和DB3的说法中,正确的是________(填标号)。
A.中心原子的价层电子对数目相等 B.都是非极性分子
C.中心原子的孤电子对数目相等 D.都含有极性键
E.都能与Na2O反应 F.固态时晶体类型不同
(5)D在空气中燃烧的产物分子构型为_________。固体DB3中存在如图所示的三聚分子,该分子中D原子的杂化轨道类型为________。

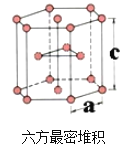
(6)E单质有两种同素异形体,高温下是体心立方堆积;但在常温下的晶体结构为如下图所示的六方最密堆积(底面是正六边形)。已知常温下晶体晶胞参数分别为a cm和c cm,则该晶体的密度可表示为________g·cm-3。(用含a和c的式子表示,用NA表示阿伏伽德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、硫、氯元素在科研与生产中也有许多重要的用途。请回答下列问题:
(1)磷原子在成键时,能将一个3s电子激发进入3d能级而参加成键,写出该激发态原子的核外电子排布式________ 。
(2)N和P都有+5价,PCl5能形成离子型晶体,晶格中含有[PCl4]+和[PCl6]-,则[PCl4]+空间构型为___________。但NCl5不存在,其原因是___________________。
(3)N、P两种元素都能形成多种气态氢化物。联氨(N2H4)为二元弱碱,在水中的电离与氨相似,写出联氨在水中第一步电离方程式_______________________。
(4)①请推测①HC1O4、②H5IO6[可写成(HO)5IO]、③HIO4三种物质的酸性由强到弱的顺序为_________(填序号)。
②已知一定条件下发生反应:Na2O+NaCl=Na3OCl,该反应过程中破坏和形成的化学键有_________。
(5)复杂磷酸盐有直链多磷酸盐(如图b)和环状偏磷酸盐(如图c)。其酸根阴离子都是由磷氧四面体(图a)通过共用氧原子连接而成。直链多磷酸盐的酸根离子(图b)中,磷原子和氧原子的原子个数比为n:____;含3个磷原子的环状偏磷酸盐的酸根离子(图c)的化学式为_____。

(6)多原子分子中各原子若在同一平面,且有互相平行的p轨道,则p电子可在多个原子间运动,形成离域π键。分子中的π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为Π,则SO2中的大π键应表示为___________。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为Π,则SO2中的大π键应表示为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物D对花香和果香的香味具有提升作用,故常用于化妆品工业和食品工业。有机物D可以用下面的设计方案合成。

(1)A的结构简式______,C的名称____,该流程中涉及到的共同的反应类型有____,D中的官能团的名称为_____。
(2)写出下列反应的化学方程式:
②__________________
③_________________
(3)芳香族化合物E的分子式与C相同,写出E可能结构的结构简式(可不填满):___、___、_____、____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.32g Na2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1 mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如下图所示,下列说法中错误的是

A. OA段发生反应的离子方程式为:H++OH-===H2O CO32-+H+===HCO3-
B. 当加入35mL盐酸时,产生CO2的体积为224mL
C. A点溶液中的溶质为NaC1、NaHCO3
D. 混合物中NaOH的质量0.60g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com