
【题目】乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示.将甲醛水溶液与氨水混合蒸发可制得乌洛托品.若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为

A. 1:1 B. 2:3 C. 3:2 D. 2:1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图。

(1)图中甲池是________装置(填“电解池”或“原电池”),其中OH-移向________极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH的电极的电极反应式:____________________。
(3)向乙池两电极附近分别滴加适量紫色石蕊试液,附近变红的电极为________极(填“A”或“B”),并写出此电极的反应式:________________。
(4)乙池中总反应的离子方程式:________________________。
(5)常温下,当乙池中B(Ag)极的质量增加5.40 g时,乙池的pH是________(若此时乙池中溶液的体积为500 mL);此时丙池某电极析出1.60 g某金属,则丙中的某盐溶液可能是________(填序号)。
a.MgSO4 B.CuSO4
c.NaCl D.AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解法处理含镍酸性废水并得到单质Ni的原理如图。下列说法不正确的是( )
已知:

①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH— -4e—==O2↑+2H2O
B. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C. 为了提高Ni的产率,电解过程中需要控制废水pH
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A. 放电时负极反应为:Zn-2e-+2OH-===Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3-3e-+5OH-===FeO42-+4H2O
C. 充电时,蓄电池的负极应与外接电源正极相连
D. 放电时负极附近溶液的碱性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法不符合人与自然和谐相处的是( )
A.用自行车代替燃油汽车上下班
B.用太阳能、风能、水能等能源替代化石燃料
C.将塑料、橡胶等有机垃圾深埋或倾入江海中
D.实施矿物燃料脱硫脱硝技术以减少硫、氮氧化物排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像中的曲线(纵坐标为沉淀或气体的量,横坐标为加入物质的量),其中错误的是

A.图A表示向含H+、Mg2+、Al3+、NH4+的溶液中滴加NaOH溶液产生沉淀量的关系曲线
B.图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线
C.图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线
D.图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀量的关系曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可以通过不同化学反应分别制得B、C和D三种物质,结构简式如图所示.
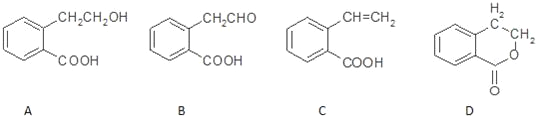
(1)A的分子式是__________; B中的含氧官能团名称是______________________.
(2)A→C的反应类型是_______________;A~D中互为同分异构体的是______________(填代号).
(3)由A生成B的化学方程式是:_____________________________________________.
(4)C在一定条件下发生加聚反应的化学方程式是:______________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家一直致力于“人工固氮”的方法研究。
(1)目前合成氨的技术原理为:N2(g)+3H2(g) 2NH3(g) △H 该反应的能量变化如图所示。
2NH3(g) △H 该反应的能量变化如图所示。

①在反应体系中加入催化剂,反应速率增大,E2的变化是:______________。(填“增大”、“减小”或“不变”)。
②将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下发生如下反应:![]()
5分钟后达到平衡,测得N2为0.2 mol,H2为0.6 mol,NH3为0.2 mol。氮气的平均反应速率v(N2)=_______________,H2的转化率为_______________,该反应在此温度下的化学平衡常数为_______________。(后两空保留小数点后一位)
③欲提高②容器中H2的转化率,下列措施可行的是____________。
A.向容器中按原比例再充入原料气
B.向容器中再充入惰性气体
C.改变反应的催化剂
D.液化生成物分离出氨
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传导H+),从而实现了高转化率的电解法合成氨。其实验装置如图所示。阴极的电极反应式为_____________________。

(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:
2N2(g) +6H2O(l) ![]() 4NH3(g) +3O2(g) △H = a kJ/mol
4NH3(g) +3O2(g) △H = a kJ/mol
进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
此合成反应的a_________0。(填“大于”、“小于”或“等于”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数约为6.02×1023mol-1,下列叙述中正确的是( )
A. 7.8 g Na2S和Na2O2的混合物中含有阴离子数大于0.1×6.02×1023
B. 2 mol NO和1 mol O2混合在密闭容器中,容器内物质分子数小于2×6.02×1023
C. 6.8 g熔融的KHSO4中含有0.1NA个阳离子
D. 1.00 mol NaCl中,所有Na+的最外层电子总数为10×6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com