
|
下列变化发生时,其对应的离子方程式正确的是 | |
| [ ] | |
A. |
硫氢化钠的水解:HS-+H2O |
B. |
苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO |
C. |
向漂白粉溶液中通入适量的SO2:Ca2++2ClO-+SO2+H2O |
D. |
用铂电极电解氯化镁溶液:2Cl-+2H2O |
科目:高中化学 来源:2012-2013学年重庆市第七中学高二上学期期中考试化学试卷(带解析) 题型:实验题
(16分)(1)在中和滴定操作过程中,有以下各项因操作不当引起的实验误差,用“偏高”、“偏低”或“无影响”填空:
①滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗,使滴定结果 ;
②锥形瓶用蒸馏水洗净后,又用待测溶液润洗,使滴定结果 ;
③滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定终了无气泡,使滴定结果 ;
④滴定前平视,滴定终了俯视,使滴定结果 ;
⑤用含Na2O杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,使测得盐酸的浓度 ;
⑥洗涤锥形瓶时,误把稀食盐水当做蒸馏水,然后用锥形瓶装待测的盐酸,用NaOH标准溶液滴定时,对测得的结果 。
(2)已知H+(aq)+OH-(aq) = H2O(l) ΔH= -57.3kJ·mol-1。用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: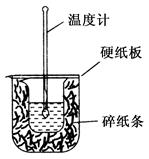
①从实验装置上看,图中尚缺少一种玻璃仪器是 。
②大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”、“偏小”或“无影响”)。
③若通过实验测定中和热的ΔH,其结果常常大于-57.3kJ·mol-1,其原因可能是:
。
(3)分别设计化学实验,用最佳方法证明明矾溶于水时发生的下列变化(供选用的药品和仪器:明矾溶液、石蕊试液、酚酞试液、pH试纸、酒精灯):
①证明明矾发生了水解反应 。
②证明其水解反应是一个吸热反应 。
查看答案和解析>>
科目:高中化学 来源:2014届重庆市高二上学期期中考试化学试卷(解析版) 题型:实验题
(16分)(1)在中和滴定操作过程中,有以下各项因操作不当引起的实验误差,用“偏高”、“偏低”或“无影响”填空:
①滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗,使滴定结果 ;
②锥形瓶用蒸馏水洗净后,又用待测溶液润洗,使滴定结果 ;
③滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定终了无气泡,使滴定结果 ;
④滴定前平视,滴定终了俯视,使滴定结果 ;
⑤用含Na2O杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,使测得盐酸的浓度 ;
⑥洗涤锥形瓶时,误把稀食盐水当做蒸馏水,然后用锥形瓶装待测的盐酸,用NaOH标准溶液滴定时,对测得的结果 。
(2)已知H+(aq)+OH-(aq) = H2O(l) ΔH= -57.3kJ·mol-1。用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
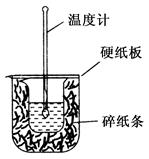
①从实验装置上看,图中尚缺少一种玻璃仪器是 。
②大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”、“偏小”或“无影响”)。
③若通过实验测定中和热的ΔH,其结果常常大于-57.3kJ·mol-1,其原因可能是:
。
(3)分别设计化学实验,用最佳方法证明明矾溶于水时发生的下列变化(供选用的药品和仪器:明矾溶液、石蕊试液、酚酞试液、pH试纸、酒精灯):
①证明明矾发生了水解反应 。
②证明其水解反应是一个吸热反应 。
查看答案和解析>>
科目:高中化学 来源:专项题 题型:填空题
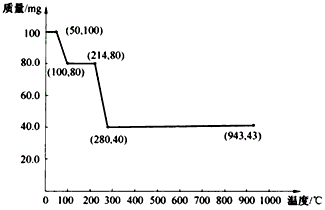
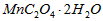 是否发生了化学变化。______________________
是否发生了化学变化。______________________查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
瑞典皇家科学院2007年10月10日宣布,将本年度诺贝尔化学奖授予德国马普学会弗里茨一哈勃研究所的格哈德?埃特尔教授,以表彰他在固体表面化学过程研究领域做出开拓性成就。格哈德?埃特尔的重要贡献之一是对哈伯一博施法合氨反应催化机理的研究。格哈德?埃特尔建立的某温度下合成氨反应机理的各步反应的能量变化如图所示,图中的能量单位为kJ?mol-1。(注:图中“吸表示在催化剂表面的吸附)
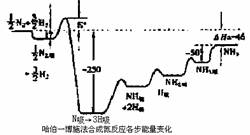
请回答下列问题:
(1)在合成氨反应中,决定反应速率的最主要的步骤是 (填字母)
A.氮分子解离为氢原子
B.氮原子的解离吸附
C.氢分子解离为氢原子
D.氨的解离吸附
(2)合成氨反应的机理为(用化学方程式表示)
① ;
②N2 ![]() N2吸
N2吸 ![]() 2N吸;
2N吸;
③ ;
④NH吸+H吸 ![]() NH3吸
NH3吸
⑤NH2吸+H吸![]() NH3吸
NH3吸 ![]() NH3
NH3
(3)某温度下合成氨反应的热化学方程式为 ;
(4)某温度下,合成氨反应Ke=3.0×103(mol?L-1)-2,该温度下,在体积恒定为10L的四个密闭容器中分别充入;(A)10mol、30mol H2和20molNH3(B)10molN2和30molH2(C)20molN2和60molH2(D)10molN2和28molH2(E)0.1molN2、0.3molH2和20MolNH3,则反应达到平衡后,N2的转化率最大的是 (填字母)。
(5)合成氨工业生产中所用的α―Fe催化剂的主要成分是FeO、Fe2O3,当催化剂中Fe3+与Fe3+的物质的量之比为1:2时,其催化剂活性最高,以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉。发生如下反应:2Fe2O3+C=4FeO+CO2,为制得该种活性最高的催化剂,应向480gFe2O3粉末加入炭粉的质量为 g.
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
汽车为推动人类文明、生活方便舒适起着重要作用,但同时也恶化了自然生态环境。汽车每年排放的一氧化碳、碳氢化合物、一氧化氮等有害气体占大气污染总量的60%以上。
(1)一氧化氮与一氧化碳都是汽车尾气中的有害气体,它们在催化转换器中能反应氮气和二氧化碳,对此反应,下列说法中正确的是( )
A.使用催化剂不能加大反应速率 B.升高温度能加大反应速率
C.改变压强对反应速率没有影响 D.降低压强能加大反应速率
(2)假设辛烷气对空气的体积之比(在相同条件下)为a,要使辛烷完全燃烧,amax是 。
(3)①若辛烷气对空气的体积之比大于amax,2mol辛烷燃烧生成的有害气体的含量为xmol时,其反应的化学方程式为 。
②当辛烷气对空气体积之比小于amax时,则尾气所污染大气的有害气体增多的是 ,产生此气体的化为方程式为 。
II、食盐中含有碘酸钾。
已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32―=2I-+S4O62-。
(1)若检验食盐中所含碘酸钾,可利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验生成的碘时,用到的主要玻璃仪器有 。
(2)测定加碘食盐中碘的含量:
a.称取a g食盐并加蒸馏水使其完全溶解;
b.将所得溶液用稀硫酸酸化,再加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,用1.0×10-3mol/L Na2S2O3溶液进行滴定,当消耗20.0mLNa2S2O3溶液时达到滴定终点。则加碘食盐样品中的碘元素含量是 mg/kg(以含a的代数式表示)。
(3)若向食盐溶液中加入淀粉溶液和KI溶液,振荡。溶液无变化。然后再滴入1滴稀H2SO4,振荡,溶液变蓝色
①用离子方程式表示实验中产生蓝色现象的可能原因 。
②根据此实验结果,请对(2)的实验结果作出简要评价: 。(填“偏大”或“偏小”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com