
 如图为直流电源电解稀Na2SO4溶液的装置.通电一段时间后,在石墨电极a和b附近分别滴加一滴酚酞溶液.则下列有关说法中正确的是( )
如图为直流电源电解稀Na2SO4溶液的装置.通电一段时间后,在石墨电极a和b附近分别滴加一滴酚酞溶液.则下列有关说法中正确的是( )| A、a电极产生H2 |
| B、两极产生的气体均有刺激性气味 |
| C、通电一段时间后,稀Na2SO4溶液酸性增强 |
| D、a电极附近呈无色,b电极附近呈红色 |


科目:高中化学 来源: 题型:
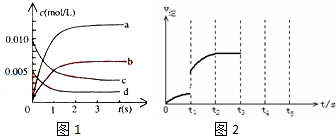
| 时间(S) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2+ |
| B、Ba2+ |
| C、CO32- |
| D、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与等体积、pH=3的盐酸比较,跟足量锌粒反应产生的H2更多 |
| B、加水稀释到原体积的10倍后溶液pH变为4 |
| C、加入少量乙酸钠固体,溶液pH升高 |
| D、溶液中粒子浓度大小关系为:c(H+)>c(CH3COOH)>c(CH3COO-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
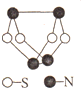 现代无机化学对硫-氮化合物的研究是最为活跃的领域之一.如图是已经合成的最著名的硫-氮化合物(S4N4)的分子结构,下列关于S4N4的说法中不正确的是( )
现代无机化学对硫-氮化合物的研究是最为活跃的领域之一.如图是已经合成的最著名的硫-氮化合物(S4N4)的分子结构,下列关于S4N4的说法中不正确的是( )| A、S4N4属于共价化合物 |
| B、S4N4中硫元素与氮元素的质量比为1:1 |
| C、S4N4分子中既有极性键又有非极性键 |
| D、S4N4分子中所有原子的最外层都达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、14 g氮气所含原子数为NA |
| B、1 mol 水中所含电子数为10NA |
| C、32gO2与32gO3所含原子数分别为2NA和3NA |
| D、0.5 molNa2CO3与1.5mol H2O所含氧原子数目均为1.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com