
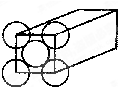
金属晶体是面心立方体,立方体的每个面5个金原子紧密堆砌(如图其余各面省略),金原子半径为d m,求
(1)金晶体中最小的一个立方体含有__________个金属原子。
(2) 欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定 ;
(3)计算一个晶胞的体积是 cm3;
(4)金的密度为_________g•cm-3。
(5)列式计算金原子的空间利用率
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:阅读理解



| ||
| 8d3 |
| ||
| 8d3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 金晶体是面心立方体,立方体的每个面5个金原子紧密堆砌(如图其余各面省略),金原子半径为1.44×10-10 m,求
金晶体是面心立方体,立方体的每个面5个金原子紧密堆砌(如图其余各面省略),金原子半径为1.44×10-10 m,求查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2011-2012学年黑龙江省鹤岗一中高二下学期期中考试化学试卷(带解析) 题型:填空题
金属晶体是面心立方体,立方体的每个面5个金原子紧密堆砌(如图其余各面省略),金原子半径为d m,求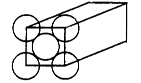
(1)金晶体中最小的一个立方体含有__________个金属原子。
(2) 欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定 ;
(3)计算一个晶胞的体积是 cm3;
(4)金的密度为_________g?cm-3。
(5)列式计算金原子的空间利用率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com