
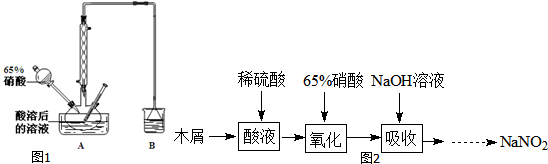
分析 (1)亚硝酸钠能氧化酸性条件下的Fe2+,生成铁离子和一氧化氮,一氧化氮在空气中迅速变色生成二氧化氮,根据电荷守恒和元素守恒可写出反应的离子方程式;
(2)屑的主要成分是纤维素[(C6H10O5)n],酸溶后得葡萄糖溶液,用葡萄糖还原硝酸得NO和NO2,用NaOH吸收NO和NO2,得到NaNO2;HNO3不稳定,温度过高发生分解,所以反应温度不宜高于60℃,NaOH溶液呈碱性,可以用碳酸钠溶液代替,据此答题;
(3)测定产品纯度,利用KMnO4氧化NO2-进行滴定计算NaNO2的含量,反应过程中高锰酸钾溶液的紫色会褪色,当达到滴定终点时,高锰酸钾溶液的紫色就不会褪色,根据电子得失守恒可得关系式2KMnO4~5NaNO2,根据KMnO4的物质的量,可求得NaNO2的质量,进而确定产品中NaNO2的纯度,若滴定终点时俯视读数,则读取的KMnO4溶液的体积偏小,所以计算出的NaNO2的质量偏小,据此答题.
解答 解:(1)亚硝酸钠能氧化酸性条件下的Fe2+,生成铁离子和一氧化氮,一氧化氮在空气中迅速变色生成二氧化氮,反应的离子方程式为Fe2++NO2-+2H+=Fe3++NO↑+H2O,
故答案为:Fe2++NO2-+2H+=Fe3++NO↑+H2O;
(2)屑的主要成分是纤维素[(C6H10O5)n],酸溶后得葡萄糖溶液,用葡萄糖还原硝酸得NO和NO2,用NaOH吸收NO和NO2,得到NaNO2;HNO3不稳定,温度过高发生分解,所以反应温度不宜高于60℃,溶NaOH液呈碱性,可以用碳酸钠溶液代替,
①根据上面的分析可知,A中有硝酸参加反应,硝酸受热易分解,降低了原料利用率,所以反应温度不宜高于60℃,
故答案为:免硝酸分解,降低原料利用率;
②不经过任何处理,按此过程进行,氢氧化钠溶液吸收后的溶液中除OH-外还有两种阴离子,其中一种是NO2-,另一种为NO3-,根据反应C6H12O6+12HNO3═3HOOC-COOH+9NO2↑+3NO↑+9H2O可知,得到的NO和NO2的体积比为1:3,根据反应NO+NO2+2NaOH═2NaNO2+H2O,2NO2+2NaOH═NaNO3+NaNO2+H2O可得反应NO+3NO2+4NaOH═3NaNO2+NaNO3+2H2O,所以溶液中NO2-与NO3-的物质的量之比为3:1,故答案为:3:1;
③NaOH溶液呈碱性,可以用碳酸钠溶液代替,故选B;
(3)测定产品纯度,利用KMnO4氧化NO2-进行滴定计算NaNO2的含量,反应过程中高锰酸钾溶液的紫色会褪色,当达到滴定终点时,高锰酸钾溶液的紫色就不会褪色,根据电子得失守恒可得关系式2KMnO4~5NaNO2,根据KMnO4的物质的量,可求得NaNO2的质量,进而确定产品中NaNO2的纯度,若滴定终点时俯视读数,则读取的KMnO4溶液的体积偏小,所以计算出的NaNO2的质量偏小,
①锥形瓶中发生反应为高锰酸钾氧化亚硝酸钠,反应的离子方程式为5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O,
故答案为:5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O;
②根据上面的分析可知,滴定至终点的现象为溶液由无色变紫红色且半分钟不褪色,
故答案为:溶液由无色变紫红色且半分钟不褪色;
③KMnO4的物质的量为cV×10-3 mol,根据反应5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O可知,NaNO2的物质的量为2.5cV×10-3 mol,所以产品中NaNO2的纯度为 $\frac{2.5cV×10{\;}^{-3}mol×\frac{100mL}{20mL}×69g/mol}{ag}$×100%,
故答案为:$\frac{2.5cV×10{\;}^{-3}mol×\frac{100mL}{20mL}×69g/mol}{ag}$×100%;
④滴定终点时俯视读数,则读取的KMnO4溶液的体积偏小,所以计算出的NaNO2的质量偏小,则测得的产品中NaNO2的纯度偏小,
故答案为:偏低.
点评 本题考查物质制备实验方案设计与探究,为高频考点,把握制备原理、实验技能为解答的关键,侧重分析与实验能力的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
 (1)已知:在常温下,浓度均为0.1mol•L-1的下列六种溶液的pH:
(1)已知:在常温下,浓度均为0.1mol•L-1的下列六种溶液的pH:| 溶质 | CH3CO ONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  依据图可判断正反应为放热反应 | |
| B. |  在图中,虚线可表示压缩反应装置体积的情况 | |
| C. | 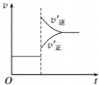 若正反应的△H>0,图可表示升高温度使平衡向逆反应方向移动 | |
| D. | 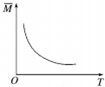 由图中混合气体的平均相对分子质量随温度的变化情况,可推知逆反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 2-甲基-2,4-己二烯
2-甲基-2,4-己二烯
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 己二酸
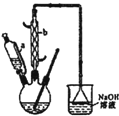
己二酸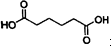 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下: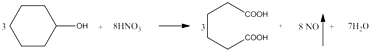
| 物质 | 密度(g/cm3) | 熔点 | 沸点 | 溶解性 | 相对分子质量 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度为3.6g,可混溶于乙醇、苯 | 100 |
| 己二酸 | 1.360/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯 | 146 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和NaOH完全反应的中和热为-114.6kJ/mol | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则表示CO燃烧热的热化学方程式为2CO(g)+O2(g)═2CO2(g);△H=-283.0kJ/mol | |
| C. | 一个化学反应的热效应,只与反应的始态与终态有关,与反应的过程无关 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下溶解度:CaCO3<Na2CO3<NaHCO3 | |
| B. | 氧化性:Mg2+<H+<Cu2+<Fe3+ | |
| C. | 酸性:H4SiO4<H3PO4<H2SO4<HClO | |
| D. | 沸点:SiC>I2>Si>HF |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com