
(15分)甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 |
|
|
(1)反应②是 (填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如下图所示。则平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。

(3)在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是 。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是 。

(4)甲醇燃料电池有着广泛的用途,同时Al—AgO电池是应用广泛的鱼雷电 池,其原 理 如右图所示。该电池的负极反应式是 。

(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为 。
(15分)(1)吸热(2分)
(2)=(2分) K1·K2(2分)
(3)加入催化剂(2分);将容器的体积(快速)压缩至2L(2分)
(4)Al-3e- + 4OH- = AlO2- + 2H2O(2分)
(5) ×10-7 (3分)
×10-7 (3分)
【解析】
试题分析:(1)温度升高,反应②的化学平衡常数增大,说明升温对正反应有利,所以正反应是吸热反应;
(2)A与B的平衡状态不同,但温度相同,所以化学平衡常数相同,K(A)=K(B);根据盖斯定律,③=①+②,所以K3=K1·K2;
(3)曲线Ⅱ与曲线I相比,CO的浓度未变,说明平衡未移动,但达平衡的时间缩短,说明反应速率加快,所以改变的条件是使用了催化剂;曲线III与曲线I相比,t0时刻CO的浓度瞬间增大到3mol/L,所以只能是缩小容器的体积,压强增大,因为反应②是反应前后气体物质的量不变的反应,所以平衡不移动,曲线I与曲线III中的CO的物质的量相等,原平衡中CO的物质的量是3mol/L×3L=9mol,所以新平衡时容器的体积是9mol/4.5mol/L=2L,所以改变的条件是将容器的体积(快速)压缩至2L;
(4)Al比Ag活泼,所以Al做负极,失去电子生成的铝离子与氢氧根离子反应最终生成偏铝酸根离子和水,电极反应式为Al-3e- + 4OH- = AlO2- + 2H2O
(5)反应平衡时,2c(Ba2+)=c(CH3COO-),根据电荷守恒规律,有反应平衡时,2c(Ba2+)+c(H+)=c(CH3COO-)+c(OH-),所以溶液为中性,c(H+)= c(OH-)=1×10-7mol/L,醋酸是弱酸,氢氧化钡是强碱,所以醋酸钡的溶液应呈碱性,现在溶液为中性,说明醋酸过量,设醋酸、氢氧化钡的体积均是1L,完全反应后c(Ba2+)=b/2mol/L,所以溶液中剩余醋酸的浓度为(a-2b)mol/2L,c(CH3COO-)=2 c(Ba2+)=2×b/2mol/L=bmol/L,该混合溶液中醋酸的电离常数为K= c(CH3COO-)·c(H+)/ c(CH3COOH)= ×10-7
×10-7
考点:考查化学反应热效应的判断,盖斯定律的应用,对图像的分析,电化学原理的应用,化学平衡常数的计算


科目:高中化学 来源:2013-2014北京市大兴区高三统一练习理综化学试卷(解析版) 题型:选择题
下列图片中的资料对应的说法正确的是
| A | B | C | D |
资料 |
聚乙烯可做 包装材料 |
分类收集垃圾有利于资源的回收利用 |
水果、蔬菜、肉类都含重要的营养物质 |
服用补铁剂同时服用Vc片 |
说法 | 无毒,用于食品、药品包装 | 废旧手机电池放入此标志的垃圾桶 | 柠檬是酸性食品,肉类是碱性食品
| 利用Vc酸性OTC表示非处方药 |
查看答案和解析>>
科目:高中化学 来源:2013-2014内蒙古鄂尔多斯市高一下学期期末质量检测化学试卷(解析版) 题型:选择题
根据下列反应事实:①X+Y2+=X2++Y;②Z+2H2O(冷)=Z(OH)2+H2↑;
③Z2+氧化性比X2+弱;④由Y、W电极组成的电池,电极反应为W2++2e-=W、
Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序为
A.X>Z>Y>W B.Z>W>X>Y C.Z>Y>X>W D.Z>X>Y>W
查看答案和解析>>
科目:高中化学 来源:2013-2014内蒙古赤峰市高三下学期4月统一考试理综化学试卷(解析版) 题型:填空题
(14分)合成氨是人类研究的重要课题,目前工业合成氨的原理为:
合成氨是人类研究的重要课题,目前工业合成氨的原理为:
N2(g)+3H2(g) 2NH3(g)△H=-93.0kJ?mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
2NH3(g)△H=-93.0kJ?mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
相持恒温、恒容,测的反应达到平衡时关系数据如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2mol NH3 |
达到平衡的时间/min |
| 6 | 8 |
平衡时 N2的体积密度 | C1 | 1.5 |
|
混合气体密度/g·L-1 |
|
|
|
平衡常数/ L2·mol-2 | K甲 | K乙 | K丙 |
(1)下列各项能说明该反应已到达平衡状态的是 (填写序号字母)
a.容器内H2、N2 、NH3的浓度只比为1:3:2 b.容器内压强保持不变
c. d.混合气体的密度保持不变
d.混合气体的密度保持不变
e.混合气体的平均相对分子质量不变
(2)容器乙中反应从开始到达平衡的反应速度为 =
=
(3)在该温度下甲容器中反应的平衡常数K (用含C1的代数式表示)
(4)分析上表数据,下列关系正确的是 (填序号):
a. b.氮气的转化率:
b.氮气的转化率: c.
c.  d.
d.
(5)另据报道,常温、常压下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH3和O2。已知:H2的燃烧热△H=-286KJ/mol,则由次原理制NH3反应的热化学方程式为
(6)希腊阿里斯多德大学的George Mamellos和Michacl Stoukides,发明了一种合成氨的新方法,在常压下,把氢气和用氨气稀释的氮气分别通入一个加热到 的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N2不断地通入 极,该电极反应式为 。
的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N2不断地通入 极,该电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014内蒙古赤峰市高三下学期4月统一考试理综化学试卷(解析版) 题型:填空题
有机物X的蒸气相对氢气的密度为51,X中氧元素的质量分数为31.7%,则能在碱性溶液中发生反应的X的同分异构体有(不考虑立体异构)( )
A.15种 B.14种 C.13种 D.12种
查看答案和解析>>
科目:高中化学 来源:2013-2014内蒙古赤峰市年宁城县高三5月模拟考试理综化学试卷(解析版) 题型:选择题
下列有关叙述正确的是 ( )
A.等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)= c(HCO )+c(H2CO3)
)+c(H2CO3)
B.pH=4.5的柠檬汁中c(H+)是pH=6.5的番茄汁中c(H+)的100倍
C.100 ml pH=3的HA溶液、HB溶液分别与足量的锌反应,HA溶液放出的氢气较多,说明HA的酸性比HB的强
D.pH=5.5的CH3COOH与CH3COONa混合溶液中:c(Na+)> c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省红河州高三下学期毕业生复习统一检测理综化学试卷(解析版) 题型:填空题
(15分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
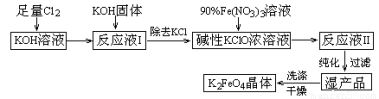
已知:① 2KOH + Cl2 = KCl + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 = 5KCl + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4可作为新型多功能水处理剂的原因 ;
(4)与MnO2 — Zn电池类似,K2FeO4 — Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为________,该电池总反应的离子方程式为_____。
(5)在“反应液I ”中加KOH固体的目的是① ,② ;
(6)从“反应液II ”中分离出K2FeO4后,副产品是 (写化学式)。
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高二下学期第二次月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24L苯中含有的C-H键的数目为0.6NA
B.标准状况下,由H2O2分解制得4.48LO2转移的电子数目为0.8NA
C.14 g 由乙烯与环丙烷(C3H6)组成的混合气体含有的碳原子数目为NA
D.常温下,1 L pH=2的H2SO4溶液中含有的H+数目为0.02NA
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高一下学期期末考试化学试卷(解析版) 题型:选择题
在一定温度下的固定容积的密闭容器中,当下列物理量不再变化时,表明反应:
A(s)+2B(g) C(g)+D(g) 已达平衡的是
C(g)+D(g) 已达平衡的是
A.混合气体的压强 B.混合气体的密度
C.生成l mol C的同时生成l mol D D.气体的总物质的量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com