
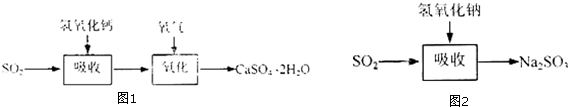
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
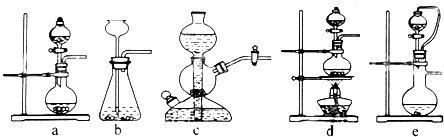
分析 (1)用硫酸和亚硫酸钠制取二氧化硫,反应物是固液混合,且该反应不需要加热,所以可以采用固液混合不加热型装置,希望能控制反应速度,则盛放硫酸的仪器必须含有活塞而能控制液体量;
(2)由硫守恒可得:Na2SO3~SO2,根据关系式及二氧化硫的物质的量计算出需要亚硫酸钠的质量;设没有变质的亚硫酸钠为100g,根据变质的质量计算出变质后溶液中亚硫酸钠的质量分数,再计算出需要变质后的亚硫酸钠的质量;
(3)根据石灰-石膏法和碱法吸收二氧化硫的原理分析相同之处;利用题中已知信息及反应原理判断石灰-石膏法的优点和缺点;
(4)将亚硫酸钠和氢氧化钙发生复分解反应生成NaOH,然后再将亚硫钙氧化得到二水硫酸钙,这样NaOH能循环利用.
解答 解:(1)用硫酸和亚硫酸钠制取二氧化硫,反应物是固液混合,且该反应不需要加热,所以可以采用固液混合不加热型装置,希望能控制反应速度,则盛放硫酸的仪器必须含有活塞而能控制液体量,符合条件的是ae装置,故选ae;
(2)由硫守恒可得:Na2SO3~SO2,因此需称取亚硫酸钠的质量为:m(Na2SO3)=126g•mol-1×$\frac{3.36L}{22.4L/mol}$=18.9g;
设没有变质的亚硫酸钠为100g,则有40g亚硫酸钠被氧化成硫酸钠,4g亚硫酸氧化为硫酸钠后质量变为:4g×$\frac{142}{126}$=45g,则有40%亚硫酸钠被氧化为硫酸钠的样品中亚硫酸钠的质量分数为:$\frac{100g-40g}{100g-40g+45g}$×100%=57.14%,
因此称取变质后样品的质量应为:$\frac{18.9g}{57.14%}$=33.1g;
故答案为:18.9;33.1;
(3)灰-石膏法与碱法吸收SO2都是利用SO2是酸性氧化物可与碱反应的性质来吸收SO2的;利用题中已知和有关信息可知采用石灰-石膏法所用原料易得、成本低等;由于吸收产物亚硫酸钙由管道输送至氧化塔氧化,所以缺点为亚硫酸钙在输送中容易造成管道堵塞,导致吸收速率慢、效率低,
故答案为:利用SO2是酸性氧化物,可与碱反应;原料易得,成本低;亚硫酸钙在输送中容易造成管道堵塞,吸收速率慢,效率低;
(4)将亚硫酸钠和氢氧化钙发生复分解反应生成NaOH,然后再将亚硫钙氧化得到二水硫酸钙,这样NaOH能循环利用,改进后的流程图为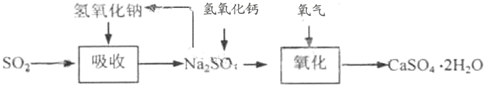 ,故答案为:
,故答案为: .
.
点评 本题考查物质制备,为高频考点,明确实验原理及实验操作方法、仪器用途等知识点是解本题关键,易错点是(2)题计算,很多在计算需要被氧化的亚硫酸钠质量时直接用第一问求得的亚硫酸钠质量除以其60%,漏掉被氧化后固体质量增加,难点是(4)题实验设计,题目难度中等.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①⑥ | C. | ②④ | D. | 只有① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
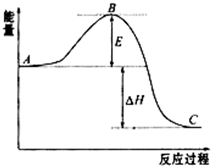 (1)已知拆开1mol H-H键、1mol I-I、1mol H-I键分别需要吸收的能量为436kJ、151kJ、295kJ,则由氢气和碘反应生成1mol HI的反应热 为-1.5kJ/mol
(1)已知拆开1mol H-H键、1mol I-I、1mol H-I键分别需要吸收的能量为436kJ、151kJ、295kJ,则由氢气和碘反应生成1mol HI的反应热 为-1.5kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al还原性依次增强 | |
| B. | HCl、H2S、PH3稳定性依次减弱 | |
| C. | NaOH、KOH、Mg(OH)2碱性依次增强 | |
| D. | S2-、Cl-、K+、Ca2+离子半径依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ,该反应属于取代反应类型.
,该反应属于取代反应类型.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
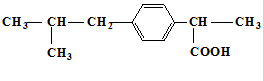 ,下列关于“芬必得”主要成分的叙述中不正确的是( )
,下列关于“芬必得”主要成分的叙述中不正确的是( )| A. | 该物质的分子式为C13H18O2 | B. | 该物质属于芳香烃 | ||
| C. | 该物质属于羧酸类有机物 | D. | 该物质可以发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水能导电,所以氯气是电解质 | |
| B. | 氯化钙溶液在电流作用下电离出Ca2+和Cl- | |
| C. | 易溶于水的化合物一定是强电解质 | |
| D. | 硝酸钠在水中的电离方程式为NaNO3═Na++NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com