
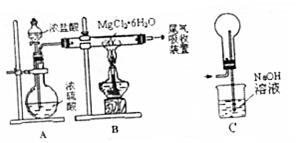
| A. | 装置A制取HCl利用了浓硫酸的吸水性 | |
| B. | 如果直接加热MgCl2•6H2O不能得到MgCl2,将得到Mg(OH)Cl或MgO | |
| C. | 用装置C做为尾气吸收装置,直接与B相连 | |
| D. | 这套装置在设计时未考虑反应结束后滞留在装置中的有害气体的吸收 |
分析 A、浓硫酸有吸水性;
B、直接加热MgCl2•6H2O会引起镁离子水解;
C、用装置C吸收氯气尾气,容易引起倒吸;
D、此装置在反应完成后仍残留有HCl.
解答 解:A、浓硫酸有吸水性,而浓盐酸易挥发,故将浓盐酸中滴加到浓硫酸中,会制得HCl气体,这是利用了浓硫酸的吸水性,故A正确;
B、直接加热MgCl2•6H2O会引起镁离子水解,最终制得Mg(OH)Cl或MgO,故若制取无水氯化镁,应在HCl气流中加热,故B正确;
C、氯气在氢氧化钠溶液中溶解度较大,故直接将装置C连到B装置上吸收氯气尾气,容易引起倒吸而引起B中硬质玻璃管炸裂,故C错误;
D、此装置在反应完成后仍残留有HCl气体,故应添加鼓入干燥空气的装置,将装置中的HCl气体排出从而除去,故D正确.
故选C.
点评 本题考查学生对实验原理的理解、盐类水解、Mg元素单质及化合物的性质等,难度中等,注意基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用金属活动性顺序可解释反应:Na(l)+KCl(l)═NaCl(l)+K(g) | |
| B. | 水的电离是吸热过程,升高温度,水的离子积增大、pH减小 | |
| C. | 对于平衡2HI(g)?I2(g)+H2(g),压缩容器体积,平衡不移动,气体的颜色不变 | |
| D. | 由反应SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,可得出C的非金属性强于Si |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑧⑨⑩ | B. | ②③⑥⑦⑨ | C. | ②③⑥⑦ | D. | ④⑤⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢氧化物 | Al(OH)3 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 8.54 | 2.01 | 7.11 |
| 完全沉淀的pH | 4.77 | 11.04 | 3.68 | 9.61 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑥ | B. | ②③⑤⑦ | C. | ②⑤⑦ | D. | ②④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5molCl2通入足量水中充分反应.转移的电子数等于0.5NA | |
| B. | 46gNO2和N2O4混合气体中含有原子总数为3NA | |
| C. | 标准状况下,22.4LSO3中含有的分子数为NA. | |
| D. | 1L0.1mol/L的NaHSO3溶液中,HSO32-、SO32-的离子数之和为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com