
| A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) |
| B.浓度均为0.1 mol·L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
| C.将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/c(H+)减小 |
| D.等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,a+b=14 |
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源:不详 题型:单选题
| A.Na+、HCO3-、SO32-、OH- | B.Al3+、H+、SiO32-、I- |
| C.Fe2+、K+、NO3-、SO42- | D.Fe3+、NH4+、ClO-、CO32- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下,0.1 mol/L NH4Cl溶液加蒸馏水稀释,溶液的pH不断增大,但无限接近7 |
| B.25 ℃时,溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14 |
| C.pH=6的纯水中,c(OH-)=10-8 mol·L-1 |
| D.稀释0.01 mol·L-1的醋酸溶液时,溶液中所有的离子浓度均减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
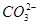 、
、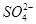 、
、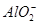 、
、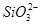 、
、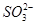
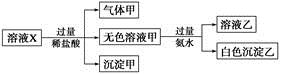
| A.气体甲一定是纯净物 |
| B.沉淀甲是硅酸和硅酸镁的混合物 |
C.K+、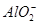 和 和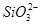 一定存在于溶液X中 一定存在于溶液X中 |
D.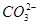 和 和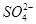 一定不存在于溶液X中 一定不存在于溶液X中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
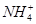 )由大到小的顺序为________;
)由大到小的顺序为________;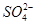 。该溶液中c(H+)_________________________c(OH-)+c(
。该溶液中c(H+)_________________________c(OH-)+c(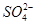 )(填“>”“=”或“<”)。
)(填“>”“=”或“<”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(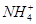 )、c(H+)均减小 )、c(H+)均减小 |
B.常温下,c(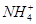 )相等的①(NH4)2SO4、②(NH4)2Fe(SO4)2、③NH4Cl、④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③ )相等的①(NH4)2SO4、②(NH4)2Fe(SO4)2、③NH4Cl、④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③ |
| C.pH相等的CH3COONa、NaHCO3和Na2CO3三种溶液:c(CH3COONa)<c(NaHCO3)<c(Na2CO3) |
| D.某温度时水的离子积常数KW=10-13,若将此温度下pH=11的NaOH溶液a L与pH=1的稀硫酸b L混合,若所得混合液pH=2,则a∶b=2∶9 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
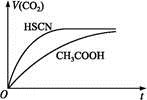
| A.c(CH3COO-) | B.c(H+) | C.KW | D.醋酸电离平衡常数 |
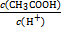
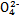 )(填“<”“>”或“=”)。
)(填“<”“>”或“=”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 实验编号 | HA | NaOH | 混合溶液的pH |
| 甲 | [HA]=0.2 mol·L-1 | [NaOH]=0.2 mol·L-1 | pH=a |
| 乙 | [HA]=c1 mol·L-1 | [NaOH]=0.2 mol·L-1 | pH=7 |
| 丙 | [HA]=0.1 mol·L-1 | [NaOH]=0.1 mol·L-1 | pH=9 |
| 丁 | pH=2 | pH=12 | pH=b |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铝溶于烧碱溶液:Al+2OH-=AlO2-+H2↑ |
B.用铜电极电解硫酸铜溶液:2Cu2++ 2H2O 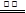 2Cu↓ +O2↑ +4H+ 2Cu↓ +O2↑ +4H+ |
C.用FeCl3饱和溶液制备Fe(OH)3胶体:Fe3++3H2O(沸水) Fe(OH)3(胶体)+3H+ Fe(OH)3(胶体)+3H+ |
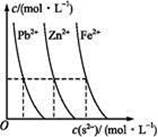
| D.已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中,形成无色溶液。当Pb(CH3COO)2溶液中通入H2S气体时有黑色沉淀生成:Pb2++H2S=PbS↓+2H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com