



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
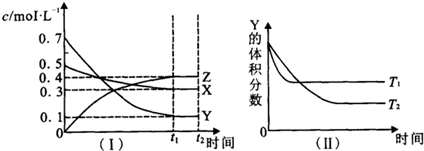
| A��ͼ������T1��T2��������Ӧ�����ȷ�Ӧ |
| B��t2 minʱ������ѹǿ���䣬ͨ��ϡ�����壬ƽ��������Ӧ�����ƶ� |
| C�������������䣬�����¶ȣ������淴Ӧ���ʾ�������X��ת�������� |
| D��T��ʱ�����ܱ������и�������ʼŨ��Ϊ��0.4mol?L-1 X��0.4mol?L-1 Y��0.2mol/L Z���������������䣬�ﵽƽ��ʱz��Ũ��Ϊ0.4 mol?L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����ݷ����к��е���ԭ�ӵĸ��������ΪһԪ�ᡢ��Ԫ��� |
| B�����ݷ�Ӧ�е������仯������ѧ��Ӧ��Ϊ�������ϣ��ֽ⣬�û������ֽ⡱���� |
| C��������Һ����������ǿ����������ʷ�Ϊǿ����ʺ�������� |
| D��KOH��NH3?H2O���Ǽ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
14 6 |
14 6 |
14 6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Fe��OH��3��������Fe��OH��3+3H+�TFe3++3H2O |
| B����NaHCO3��Һ�м�������Ca��OH��2��Һ��2HCO+Ca2++2OH-�TCaCO3��+CO32-+2H2O |
C������Һ�еμ�Na2CO3��Һ�� |
| D�����Ȼ�������Һ�еμ�ϡ���Fe2++2H++NO�TFe3++NO2��+H2O |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com