
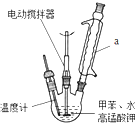
 ��������һ�ֻ���ԭ�ϣ���������ҩ��Ⱦ�ϵ��м��壬Ҳ������ȡ���ܼ������ϵȣ�ʵ���Һϳɱ������ԭ�����й����ݼ�װ��ʾ��ͼ���£�
��������һ�ֻ���ԭ�ϣ���������ҩ��Ⱦ�ϵ��м��壬Ҳ������ȡ���ܼ������ϵȣ�ʵ���Һϳɱ������ԭ�����й����ݼ�װ��ʾ��ͼ���£�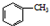 $��_{��}^{KMnO_{4}}$
$��_{��}^{KMnO_{4}}$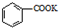 $\stackrel{HCl}{��}$
$\stackrel{HCl}{��}$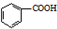
| ���� | ��״ | �۵㣨�棩 | �е㣨�棩 | �ܶȣ�g/mL�� | �ܽ�ȣ�g�� | |
| ˮ | �Ҵ� | |||||
| �ױ� | ��ɫҺ����ȼ�ӷ� | -95 | 110.6 | 0.8669 | ���� | ���� |
| ������ | ��ɫƬ״����״���� | 122.4[1] | 248 | 1.2659 | ��[2] | ���� |

���� I����1���ױ�������ˮ��ֲ㣬��Ӧ���ɵı������������ˮ��װ��a�����������������ױ��������ط�Ӧ���ɱ�����ء��������̡�ˮ���������أ�����Ԫ���غ���ƽ����ʽ��
II����1�����������ƾ��л�ԭ�ԣ��ܻ�ԭ������أ�
��2�����˳�ȥ�����ԵĶ������̣����ȹ��˿��Է�ֹ������ؽᾧ������
��4���������е�����Ϊ�Ȼ��أ����ݶ����������ʵIJ�������
III�����������������ط�Ӧ���ɱ�����أ��������ˮ���Լ��ԣ�Ӧ���÷�̪��ָʾ���������������ص����ʵ����������������ʵ��������������������������
��� �⣺I����1���ױ�������ˮ��ֲ㣬��Ӧ���ɵı������������ˮ�����Է�Ӧ��Ļ����Һ���ٷֲ㣬˵���ױ���ȫ��Ӧ��װ��a����������ˮ�������ױ���������ֹ�ױ��Ļӷ������Ͳ�Ʒ���ʣ��ױ��������ط�Ӧ���ɱ�����ء��������̡�ˮ���������أ���Ӧ����ʽΪ�� +2KMnO4$\stackrel{��}{��}$
+2KMnO4$\stackrel{��}{��}$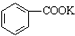 +2MnO2��+H2O+KOH��
+2MnO2��+H2O+KOH��
�ʴ�Ϊ���ֲ㣻���ױ���ˮ������������ֹ�ױ��Ļӷ������Ͳ�Ʒ���ʣ�2��2��1KOH��
II����1�����������ƾ��л�ԭ�ԣ��ܻ�ԭ����������ɶ������̡�����غ�ˮ���䷴Ӧ�����ӷ���ʽΪ��2MnO4-+3HSO3-+OH-=2MnO2��+3SO42-+2 H2O��
�ʴ�Ϊ��2MnO4-+3HSO3-+OH-=2MnO2��+3SO42-+2 H2O��
��2����Ӧ��Ļ�����к��ж������̹��壬���˳�ȥ�����ԵĶ������̣�������ص��ܽ�������¶ȵĽ��Ͷ���С�����Գ��ȹ��˿��Է�ֹ������ؽᾧ������
�ʴ�Ϊ����ȥ�������̲���ֹ������ؽᾧ���������ʧ��
��4���������е�����Ϊ�Ȼ��أ���������������KCl���۷е�ܸߣ��������������ᴿ�����Ȼ��صı�������Բ��������ķ�������������ˮ�е��ܽ�����¶�Ӱ��ϴ��Բ����ؽᾧ�ķ����ᴿ�����
�ʴ�Ϊ��BD��
III�����������������ط�Ӧ���ɱ�����أ��������ˮ���Լ��ԣ�Ӧ�����ڼ��������±�ɫ��ָʾ��������ѡ�÷�̪��ָʾ����
n��KOH��=cV=0.1000mol•L-1 ��0.024L=0.0024mol�����������������ص����ʵ���ǡ�÷�Ӧ����n�������ᣩ=0.0024mol��
����������Ϊ0.0024mol��122g/mol��$\frac{100ml}{25ml}$=1.1712g�����Բ�Ʒ�б�������������Ϊ$\frac{1.1712g}{1.22g}$��100%=96.00%��
�ʴ�Ϊ����̪��96.00%��
���� ���⿼���˱�������Ʊ�ʵ�鷽����ƣ��������Ʊ�ʵ����������ʵķ����ᴿ�����ӷ���ʽ����д�����ݵĴ����ͼ��㡢�ζ�ԭ����Ӧ�õ�֪ʶ��Ŀ��飬����Ʊ���ԭ���ǽ��Ĺؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
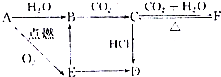
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
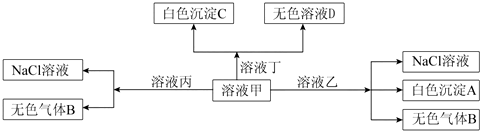
| A�� | ��Һ��һ��ΪAlCl3��Һ | |
| B�� | ��Һ����I-��NO3-��SO42-��K+һ�����Դ������� | |
| C�� | �ڼ��мӶ����ܷ�����Ӧ�����ӷ���ʽ��HCO3-+Ba2++OH-=BaCO3��+H2O | |
| D�� | ��ɫ����A�����ܽ�����ҺD�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
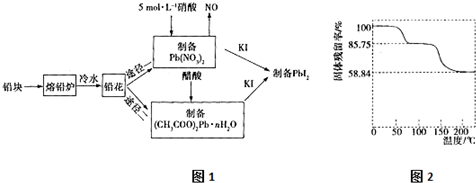
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
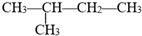 ��ϵͳ������������������2-�����飬����һ�ȴ�����4�֣���������ϩ���������ӳɶ��õ�����ϩ�����ܵĽṹ��ʽ�ǣ�CH2=��CH3��C-CH2-CH3����CH3��2C=CH-CH3����CH3��2CH-CH=CH2��
��ϵͳ������������������2-�����飬����һ�ȴ�����4�֣���������ϩ���������ӳɶ��õ�����ϩ�����ܵĽṹ��ʽ�ǣ�CH2=��CH3��C-CH2-CH3����CH3��2C=CH-CH3����CH3��2CH-CH=CH2���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��һ���������������з���m molX��n mol Y����ַ�Ӧ����Q kJ������ | |
| B�� | ��Ӧ�ﵽ�����ʱ������X����Ӧ�ġ�H���� | |
| C�� | ��Ӧ���ʦ�����X��=$\frac{m}{n}$������Y�� | |
| D�� | �����¶ȣ���Ӧ������ֵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 9.3 | B�� | 9.7 | C�� | 10.3 | D�� | 10.7 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com