
分析 A、B、C、D、E、F为前四周期原子序数依次增大的元素;A原子半径是周期表中原子半径最小的,则A是H元素;C可以和A形成两种常见的液态化合物,且原子个数之比分别是1:1和1:2,C是O元素,两种化合物为H2O2、H2O;B的基态原子中有3个未成对电子,原子序数小于氧,核外电子排布为1s2s22p3,故B为N元素;F位于周期表的ds区,F元素原子最外层有一个未成对电子,外围电子排布式为3d104s1,故F为Cu;E与C同主族,E的原子序数小于Cu,故E为S元素;D、E为同周期元索,D是所属周期的主族元素中电负性最小的,则D为Na.
解答 解:A、B、C、D、E、F为前四周期原子序数依次增大的元素;A原子半径是周期表中原子半径最小的,则A是H元素;C可以和A形成两种常见的液态化合物,且原子个数之比分别是1:1和1:2,C是O元素,两种化合物为H2O2、H2O;B的基态原子中有3个未成对电子,原子序数小于氧,核外电子排布为1s2s22p3,故B为N元素;F位于周期表的ds区,F元素原子最外层有一个未成对电子,外围电子排布式为3d104s1,故F为Cu;E与C同主族,E的原子序数小于Cu,故E为S元素;D、E为同周期元索,D是所属周期的主族元素中电负性最小的,则D为Na.
(1)Cu2+的价电子排布式是3d9,故答案为:3d9;
(2)B为N元素,C为O元素,同周期自左而右电负性增大,故电负性较大的是O,故答案为:O;
(3)SO32-中硫原子孤电子对数=$\frac{6+2-2×3}{2}$=1,价层电子对数=3=1=4,故其立体构型是三角锥形,SO3中硫原子杂化轨道数目为3+$\frac{6-2×3}{2}$=3,硫原子的杂化类型是sp2杂化,故答案为:三角锥形;sp2;
(4)由于H2O分子之间形成氢键,而H2S分子之间不能形成氢键,故水的沸点高于硫化氢的,故答案为:H2O分子之间形成氢键;
(5)由C、E、F元素组成的常见化合物为CuSO4,CuSO4中逐滴滴加NH3至过量,先生成氢氧化铜沉淀,后氢氧化铜溶解形成[Cu(NH3)4]2+,沉淀消失的离子方程式:Cu(OH)2+4NH3.H2O=[Cu(NH3)4]2++4H2O+2OH-,
故答案为:Cu(OH)2+4NH3.H2O=[Cu(NH3)4]2++4H2O+2OH-.
点评 本题是对物质结构与性质的考查,涉及位置结构性质关系和应用、核外电子排布、电负性、空间构型与杂化方式、氢键、配合物等,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 碱金属单质的熔、沸点逐渐降低 | B. | 卤素单质的熔、沸点逐渐降低 | ||
| C. | 碱金属单质的密度逐渐增大 | D. | 卤素单质的密度逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
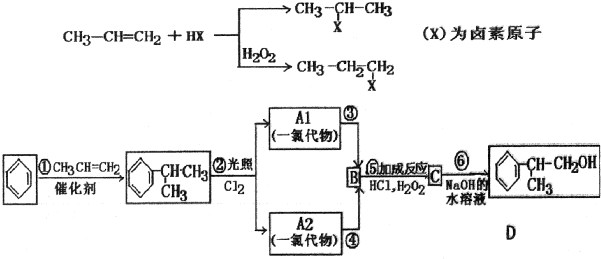
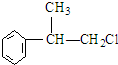 、,
、,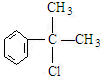 ;
; ,C的结构简式:
,C的结构简式: ;
; +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaCl;
+NaCl;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁设备与直流电源正极相连可防腐 | |
| B. | 明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒 | |
| C. | 开启啤酒瓶后,瓶中立刻泛起大量泡沫不能用勒夏特列原理解释 | |
| D. | 废旧电池中的汞、锅、铅等重金属盐对土壤和水源会造成污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①③④ | C. | ②③⑥ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应一定只伴随热量的变化 | |
| B. | 凡是吸热或放热过程中热量的变化均称为反应热 | |
| C. | 若△H<0,则反应物的能量高于生成物的能量 | |
| D. | 若△H>0,则反应物的能量高于生成物的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用铁作电极电解饱和氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 高锰酸钾在酸性介质中与草酸反应:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8 H2O | |
| C. | FeCl2与K3[Fe(CN)6]反应:2Fe2++3[Fe(CN)6]3-═Fe2[Fe(CN)6]3↓ | |
| D. | 向KI和H2SO4的混合溶液中通入空气:4H++4I-+O2=2I2+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com