
| A、0.04 mol?L-1 1 |
| B、0.02 mol?L-1 2 |
| C、0.03 mol?L-1 5 |
| D、0.05mol?L-1 1 |
| ||
| n |
| V |
| 0.01mol |
| 0.2L |
| ||
| 0.01mol×2 |
| 0.2L |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
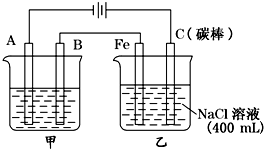 如图为相互串联的甲乙两电解池
如图为相互串联的甲乙两电解池| 物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| KSP | 8.0×10-16 | 4.0×10-38 | 3.0×10-17 | 2.2×10-20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、14.2mg | ||
| B、174g | ||
C、
| ||
| D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应率的影响,在常温下按照如下方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应率的影响,在常温下按照如下方案完成实验. | 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2溶液 | 1mL 0.1mol?L-1 FeCl3溶液 |
| ④ | 10mL 5% H2O2溶液+少量HCl溶液 | 1mL 0.1mol?L-1 FeCl3溶液 |
| ⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 1mL 0.1mol?L-1 FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某无色溶液中仅加入AgNO3溶液,以检验未知溶液中的Cl- | ||
| B、用洗气瓶中的NaOH溶液除去CO2气体中混有的HCl气体 | ||
C、向某无色溶液中仅加入BaCl2溶液,以检验未知溶液中的SO
| ||
| D、用加入适量铜粉的方法除去Cu(NO3)2溶液中的AgNO3杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 组别 | 药品1 | 药品2 | 实验现象 |
| Ⅰ | 0.01mol/L NaOH溶液 | 0.01mol/L MgCl2溶液 | 生成白色沉淀 |
| Ⅱ | 0.01mol/L氨水 | 0.01mol/L MgCl2溶液 | 无现象 |
| Ⅲ | 0.1mol/L氨水 | 0.1mol/L MgCl2溶液 | |
| IV | 0.1mol/L氨水 | 0.01mol/L MgCl2溶液 | 生成白色沉淀 |
| V | 0.01mol/L氨水 | 0.1mol/L MgCl2溶液 | 无现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0 mol和 10% |
| B、2.0 mol和 80% |
| C、2.0 mol和 40% |
| D、2.0 mol和 20% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化钾 | B、氯化汞 |
| C、氯化镁 | D、氯化钡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com