
| A. | A、B、C三种元素形成的化合物中肯定只含共价键 | |
| B. | A、C形成的化合物中只有A-C键 | |
| C. | 工业上生产单质D可用海水作原料获得 | |
| D. | 化合物DC与化合物EC2中化学键类型相同 |
分析 A、B、C、D、E是短周期中原子序数依次增大的5种元素.
A、B形成的气态化合物的水溶液呈碱性,应为NH3,则A为H元素,B为N元素;
D原子最外层电子数与最内层电子数相等,原子序数比N元素大,则D为Mg元素;
B为N元素,B、C同周期,则C为第二周期元素,D为Mg元素,D与C形成的化合物是一种耐高温材料为MgO,则C为O元素;
A、B、C、D的原子序数之和是1+7+8+12=28,是E的两倍,则E的原子序数为14,为Si元素;
根据元素对应的单质、化合物的性质结合元素周期律知识解答该题.
解答 解:由分析可知:A为H元素,B为N元素,C为O元素,D为Mg元素,E为Si元素;
A、A为H元素,B为N元素,C为O元素,三种元素形成的化合物中可能含有离子键,如硝酸铵,故A错误;
B、A为H元素,C为O元素,A、C形成的化合物中H2O2中有H-O键和O-O键,故B错误;
C、从海水中提取镁,通常将熟石灰加入海水中,沉淀出氢氧化镁,氢氧化镁与盐酸反应生成氯化镁,电解熔融状态的氯化镁,就能制的金属镁,故C正确;
D、化合物MgO含有离子键,化合物SiO2中共价键,化学键类型不一样,故D错误.
故选:C.
点评 本题考查元素的推断、元素周期律以及对应元素化合物的性质,题目难度不大,注意常见元素化合物的性质和元素周期律.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
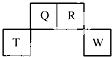 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等, .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
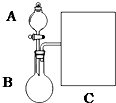 氨水是一种的常用的化学试剂.
氨水是一种的常用的化学试剂.| 实验步骤 | 实验操作 | 预期现象及结论(步骤1只填现象) |
| 1 | 在A、B两支洁净的试管中各入1mL 2%的AgNO3溶液,然后边振荡试管边逐滴滴入2%稀氨水,至最初产生的沉淀恰好完全溶解,此时制得pH均约为8的银氨溶液. | 先出现白色沉淀后沉淀溶解 |
| 2 | 往A、B试管加入3滴乙醛,然后在A试管中加多1滴NaOH溶液;振荡后将两支试管放在热水浴中温热 | 若A试管比B试管出现的银镜时间短、光亮,则溶液pH大,反应速率快;若A试管比B试管出现的银镜时间长,则溶液pH大,反应速率慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都能使品红试液褪色 | |
| B. | 都能和氢氧化钠溶液反应生成盐和水 | |
| C. | 都有刺激性气味 | |
| D. | 常温下都是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
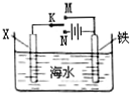
| A. | 若X为锌棒,开关K置于M处,可减缓铁的腐蚀 | |
| B. | 若X为锌棒,开关K置于M处,铁电极的反应:Fe-2e→Fe2+ | |
| C. | 若X为碳棒,开关K置于N处,可减缓铁的腐蚀 | |
| D. | 若X为碳棒,开关K置于N处,铁电极的反应:2H++2e→H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,违背了泡利不相容原理.
,违背了泡利不相容原理.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com