
| A. | 氧化还原反应的特征是元素化合价发生了变化 | |
| B. | 在水溶液中能电离出H+的化合物不一定是酸 | |
| C. | 溶液与胶体的本质区别是能否产生丁达尔现象 | |
| D. | 因为NH3溶于水的溶液能导电,所以NH3是电解质 |
分析 A.氧化还原反应的实质为电子转移,其特征为化合价变化;
B.能电离出H+的化合物可能为强酸的酸式盐;
C.溶液与胶体的本质区别为分散质的直径大小;
D.NH3本身不能电离.
解答 解:A.氧化还原反应的特征是元素化合价发生了变化,其实质为电子转移,故A正确;
B.能电离出H+的化合物可能为强酸的酸式盐,如NaHSO4的水溶液中能电离出H+,故B正确;
C.溶液与胶体的本质区别为分散质的直径大小,可利用丁达尔现象鉴别,故C错误;
D.NH3本身不能电离,则为非电解质,故D错误;
故选CD.
点评 本题考查氧化还原反应,为高频考点,把握氧化还原反应中元素的化合价变化及相关概念为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | X的气态氢化物比Y的气态氢化物稳定 | |
| B. | X的氢化物的沸点比Y的氢化物的沸点低 | |
| C. | X原子的电子层数比Y原子的电子层数多 | |
| D. | Y的单质能将X从NaX的溶液中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

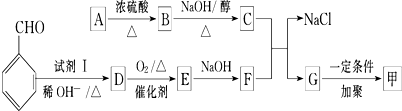
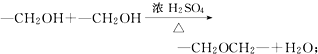

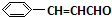 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2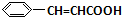 +H2O;
+H2O;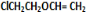 +
+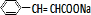 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$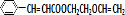 +NaCl.
+NaCl.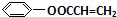 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下,1mol O2和N2混合气的体积约为22.4L. | |
| B. | 任何条件下,气体的摩尔体积都是22.4L/mol. | |
| C. | 只有在标况下,气体的摩尔体积才能是22.4L/mol. | |
| D. | 在常温常压下,11.2L Cl2所含的原子数目为NA. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4×10-7mol•L-1 | B. | 1.0×10-7mol•L-1 | ||
| C. | $\frac{1.0×1{0}^{-14}}{2.4×10-7}$ mol•L-1 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤①③②④⑥⑦ | B. | ⑤①②③⑥④⑦ | C. | ⑤③①②⑥④⑦ | D. | ⑤③②①⑥④⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com