
【题目】下列说法正确的是( )
A. 测定盐酸和NaOH溶液反应的中和热时,每次实验均应测量三个温度,即盐酸的起始温度、NaOH溶液的起始温度和反应体系的最高温度
B. HCl和NaOH反应的中和热ΔH=57.3 kJ·mol1,则稀H2SO4和稀Ca(OH)2溶液反应的中和热 ΔH=2×57.3 kJ·mol1
C. 燃烧热是指在101 kPa时可燃物完全燃烧时所放出的热量
D. S(s)+ ![]() O2(g)
O2(g)![]() SO3(g) ΔH=315 kJ·mol1 表示S燃烧热的热化学方程式
SO3(g) ΔH=315 kJ·mol1 表示S燃烧热的热化学方程式
【答案】A
【解析】
A. 测定盐酸和NaOH溶液反应的中和热时,根据ΔH=-Q/n,Q=cmΔt,需要测量溶液温度的变化,则每次实验均应测量三个温度,即盐酸的起始温度、NaOH溶液的起始温度和反应体系的最高温度,A正确;
B. HCl和NaOH反应的中和热ΔH=57.3 kJ·mol1,则稀H2SO4和稀Ca(OH)2溶液反应,除生成水放热外,还生成硫酸钙沉淀,也放出热量,则ΔH<2×57.3 kJ·mol1,B错误;
C. 燃烧热是指在101 kPa、25℃时,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,C错误;
D. S(s)+![]() O2(g)
O2(g)![]() S O3(g) ΔH=315 kJ·mol1 ,S燃烧时生成的产物为SO2气体,不是SO3,D错误;
S O3(g) ΔH=315 kJ·mol1 ,S燃烧时生成的产物为SO2气体,不是SO3,D错误;
答案为A。


科目:高中化学 来源: 题型:
【题目】如图所示,将铁棒和石墨棒插入1 L 1 mol/L食盐水中。下列说法正确的是( )
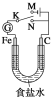
A. 若电键K与N连接,铁被保护不会腐蚀
B. 若电键K与N连接,正极反应式是4OH--4e-===2H2O+O2↑
C. 若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜
D. 若电键K与M连接,当两极共产生28 L(标准状况)气体时,生成了1 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应3A(g)![]() 3B(?)+C(?)△H>0,达到化学平衡后,进行下列操作。
3B(?)+C(?)△H>0,达到化学平衡后,进行下列操作。
(1)升高温度,用“变大”“变小”“不变”或“无法确定”填空。
①若B、C都是气体,气体的平均相对分子质量______;
②若B、C都不是气体,气体的平均相对分子质量______;
③若B是气体,C不是气体,气体的平均相对分子质量______;
(2)如果平衡后温度保持不变,将容器体积增大一倍,新平衡时A的浓度是原来的50%,判断B的状态是__________态,C的状态是__________态。
(3)某密闭容器中放入一定量的NO2,发生反应2NO2![]() N2O4(正反应放热),达平衡后,若分别单独改变下列条件,重新达到平衡后,能使混和气体平均分子量增大的是_________。
N2O4(正反应放热),达平衡后,若分别单独改变下列条件,重新达到平衡后,能使混和气体平均分子量增大的是_________。
A.通入N2 B.通入NO2 C.通入N2O4 D.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电石制备的乙炔气体中常混有少量H2S气体。请用图中仪器和药品组成一套制备、净化乙炔的装置,并可通过测定乙炔的量,从而计算电石纯度。
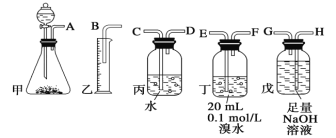
(1)电石制备乙炔气体的化学方程式____________;
(2)进行实验时,所制气体从左向右流,仪器的正确连接顺序是____________(填接口字母);
(3)为了使实验中气流平稳,甲中分液漏斗里的液体通常用_______________;
(4)若在标准状况下溴水与乙炔完全反应生成C2H2Br4,已知称取电石m g,测得量筒内液体体积V mL,则电石纯度可表示为____________;
(5)若没有装置戊,测定结果将会______(填“偏高”、“偏低”或“不变”) ,理由是(方程式表示)____;
(6)干燥乙炔可用_____________(填选项);
A. 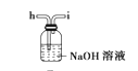
B.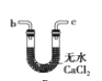
C.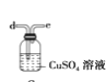
D.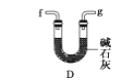
(7)为了探究乙炔与HBr发生加成反应后的有关产物,进行以下实验:纯净乙炔气 ![]() 混合液
混合液 ![]() 有机混合物Ⅰ
有机混合物Ⅰ ![]() 混合液
混合液 ![]() 有机混合物Ⅱ
有机混合物Ⅱ
①操作b的名称是________;
②有机混合物Ⅰ可能含有的物质是________(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示。
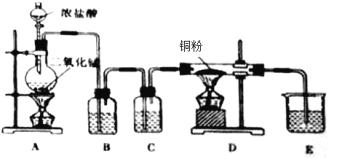
回答下列问题:
(1)写出在A中发生反应的化学方程式为:__;
(2)B中选用的试剂是__,其作用是__;
(3)E中选用的试剂是__,其作用是__;
(4)若用含有0.2molHCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12L的原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2H2(g)+02(g)=2H2O(l)过程中的能量变化如图所示,下列有关说法中正确的是

A. H1<0 B. H2为该反应的反应热
C. H3为氢气的燃烧热 D. H1=H3-H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不可能通过一步反应直接完成的是
A. Al(OH)3 → Al2O3 B. Al2O3 → Al(OH)3
C. Al → AlO2- D. Al3+ → Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol/L的NaOH溶液480 mL:
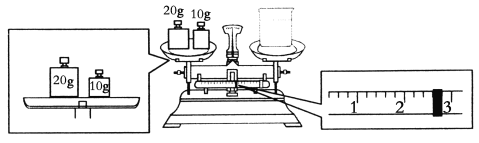
(1)配制时,必须使用的玻璃仪器有胶头滴管、烧杯、玻璃棒、________。
(2)要完成本实验该同学应称出NaOH________g。
(3)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图,烧杯的实际质量为________g。
(4)使用容量瓶前必须进行的一步操作是________。
(5)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是________。
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用KMnO4和浓盐酸反应制取氯气。
KMnO4+HCl(浓)=KCl+MnCl2+Cl2↑+H2O(未配平)
(1)配平化学方程式,并用单线桥标出电子转移的方向和数目。
(2)将上述配平的化学方程式改写为离子方程式 。
(3)浓盐酸在反应中显示出来的性质是________________
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(4)若产生0.5molCl2,则被氧化的HCl mol,转移的电子的数目约为___________。
(5)一定条件下,KMnO4还可以氧化其他还原性物质。
MnO4-+C2O42-+ = Mn2+ +CO2↑+
完成上述离子方程式,此反应中,发生氧化反应的物质是 ;若转移1mol电子,生成标准状况下CO2 L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com