
【题目】氮氧化物是造成雾霾天气的主要原因之一,消除氮氧化物有多种方法。
(1)目前,应用最广泛的烟气氮氧化物脱除技术是NH3催化还原法,化学反应可表示为:2NH3(g)+NO(g)+NO2(g)== 2N2(g)+3H2O(g)△H<0
①该反应中,反应物总能量_______(填“>”、“<”或“=”)生成物总能量。
②当该反应有2mol N2(g)生成时,转移电子的物质的量为________mol。
③该反应中,还原剂为_______(填化学式),氧化产物与还原产物的质量比为_______。
(2)也可以利用甲烷催化还原氮氧化物,已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol ;CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H2=-867kJ/mol
则CH4(g)将NO(g)还原为N2(g)的热化学方程式是_______。
(3)锌锰干电池是应用最普遍的电池之一(如图所示),总反应方程式为: Zn+2MnO2+2NH4Cl=ZnCl2+2NH3↑+Mn2O3+H2O
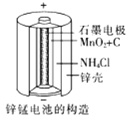
①锌锰干电池的负极材料是________,
②负极发生的电极反应方程式为:_______
③正极发生的电极反应方程式为:________。
④若反应消耗32.5 g负极材料,则电池中转移电子的数目为_______。
【答案】> 6 NH3 1:1 CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H =-1160kJmol-1 锌 Zn-2e-=Zn2+ 2![]() +2MnO2+2e-=2NH3+Mn2O3+H2O NA或6.021023
+2MnO2+2e-=2NH3+Mn2O3+H2O NA或6.021023
【解析】
(1)①△H<0,反应为放热反应,反应物总能量大于生成物总能量;
②根据化合价升高的数值=化合价降低数值=转移电子数;
③还原剂是失电子,元素的化合价升高的,氨气中氮元素化合价-3价升高为0价,故NH3做还原剂;2NH3被氧化得到1mol氧化产物N2,所以还原产物氮气物质的量为1mol,氧化产物与还原产物的质量比为1:1;
(2)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol
②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H2=-867kJ/mol
由盖斯定律计算②×2-①即可得到目标方程。
(3)从总反应式Zn+2MnO2+2NH4Cl=ZnCl2+2NH3↑+Mn2O3+H2O看出,锌元素化合价从0升至+2,失电子,为负极材料;负极反应式为Zn-2e-=Zn2+;再用总反应-负极反应式即得正极反应式;32.5g锌是0.5mol,由理论值和实际值的比例关系,可得转移的电子数。
(1)①△H<0,反应为放热反应,反应物总能量>生成物总能量;
②根据化合价升高的数值=化合价降低数值=转移电子数,化合价升高情况:2NH3~6e-~N2,所以当有2mol N2生成,该反应的电子转移的量是6mol;
③反应中氨气中氮元素化合价-3价升高为0价,失电子做还原剂被氧化得到氧化产物N2,2NH3被氧化得到1mol氧化产物N2,所以还原产物氮气物质的量为1mol,氧化产物与还原产物的质量比为1:1;
(2)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol
②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H2=-867kJ/mol
由盖斯定律计算②×2-①得到:
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol;
(3)①负极发生氧化反应,锌失电子,则锌锰干电池的负极材料是锌;
②负极电极反应式为:Zn-2e-=Zn2+;
③正极反应式=总反应式-负极反应式,即2![]() +2MnO2+2e-=2NH3+Mn2O3+H2O;
+2MnO2+2e-=2NH3+Mn2O3+H2O;
④32.5g锌是0.5mol,而1mol的锌失去2mol的电子,所以转移电子的物质的量为1mol,数目为NA或6.02×1023。


科目:高中化学 来源: 题型:
【题目】有下列几组物质,请将序号填入下列空格内:
A.CH2=CHCOOH和CH2=CH(CH2 )4 COOH B.12C60和石墨 C.![]() 和
和![]() D.35Cl和37Cl E.乙醇和乙二醇
D.35Cl和37Cl E.乙醇和乙二醇
(1)互为同位素的是________;
(2)互为同系物的是________;
(3)互为同素异形体的是________;
(4)互为同分异构体的是________;
(5)既不是同系物,又不是同分异体,也不是同素异形体,但可看成是同一类物质的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一定容积的密闭容器中进行,则下列说法或结论中,能够成立的是
CO(g)+H2(g)在一定容积的密闭容器中进行,则下列说法或结论中,能够成立的是
A.v(CO)=v(H2O)时,反应达到平衡状态
B.保持体积不变,充入少量He气体使体系压强增大,反应速率一定增大
C.其他条件不变,仅将容器的体积缩小一半,反应速率加快
D.其他条件不变,适当增加C(s)的质量会使反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究某无结晶水的正盐X(仅含有两种短周期元素)的组成和性质,设计并完成下列实验。(气体体积已转化为标准状况下的体积)
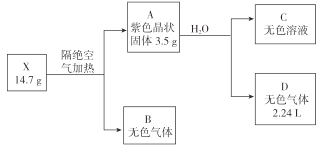
已知:B是空气的主要成分之一;C是一种强碱,且微溶于水 ,载人宇宙飞船内常用含 C的过滤网吸收宇航员呼出的CO2,以净化空气;D遇湿润的红色石蕊试纸变蓝。
(1)X的化学式为 __________________ 。
(2)图中B的组成元素在元素周期表中的位置是______________。
(3)A的电子式为 ____________。
(4)X受热分解转变成 A 和 B 的化学反应方程式为 ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是( )

A. O2在电极b上发生还原反应
B. 溶液中OH-向电极a移动
C. 反应消耗的NH3与O2的物质的量之比为4∶5
D. 负极的电极反应式为2NH3-6e-+6OH-===N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)丙烷(C3H8)是一种价格低廉的常用燃料,其主要成分是碳和氢两种元素,燃烧后只有二氧化碳和气态水,不会对环境造成污染。已知1 g丙烷完全燃烧放出50.45kJ的热量。丙烷在室温下燃烧的热化学方程式为____。
(2)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:
CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
则2CH4(g)+ O2(g)=2CO(g)+4H2(g)ΔH=___;
(3)在密闭容器中充入A(g)和B(g),它们的初始浓度均为2mol·L-1,在一定条件下发生反应:A(g)+B(g)![]() 2C(g) ΔH。该T1温度下,此反应的平衡常数为4,
2C(g) ΔH。该T1温度下,此反应的平衡常数为4,
①该反应的平衡常数的表达式为____。
②A的转化率为_____。
③若升温至T2时,此反应的平衡常数为1,判断该反应ΔH___0(填“>”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素,原子半径的大小关系为:r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子。下列说法不正确的是( )
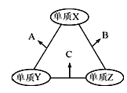
A.X元素位于ⅥA
B.A和C不可能发生氧化还原反应
C.B的沸点高于C的沸点
D.A不能溶解于B中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两个单环共用一个碳原子的多环化合物称为螺环化合物,共用的碳原子称为螺原子。螺[5,5]十一烷的结构为![]() ,下列关于该化合物的说法错误的是( )
,下列关于该化合物的说法错误的是( )
A.一溴代物有三种
B.与十一碳烯互为同分异构体
C.分子中所有碳原子不可能在同一平面
D.1mo1该化合物完全燃烧需要16mo1O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符合的是( )

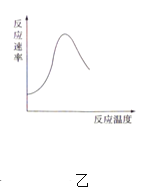


A. 图甲表示燃料燃烧反应的能量变化
B. 图乙表示酶催化反应的反应速率随反应温度的变化
C. 图丙表示除去氧化膜的镁条投入到稀盐酸中,反应速率v随时间t的变化曲线
D. 图丁表示某温度下V1mLl.0 mol/L HC1溶液和V2 mL1.5mol/L的NaOH溶液混合均匀后溶液温度随V1的变化趋势(V1+V2=50mL)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com