
 HOI(aq) ΔH2
HOI(aq) ΔH2 I2(aq)+H2O(l) ΔH3
I2(aq)+H2O(l) ΔH3 I3—(aq),其平衡常数表达式为________。
I3—(aq),其平衡常数表达式为________。| 编号 | 反应物 | 反应前pH | 反应后pH |
| 第1组 | O3+I- | 5.2 | 11.0 |
| 第2组 | O3+I-+Fe2+ | 5.2 | 4.1 |
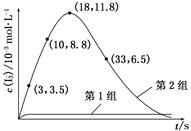
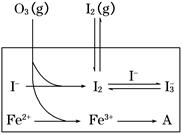
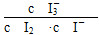 (3)①溶液中H+被消耗,生成H2O,溶液pH上升 ②Fe(OH)3 Fe3+形成Fe(OH)3过程中消耗OH-,使溶液中c(H+)上升,促进I-转化 ③BC
(3)①溶液中H+被消耗,生成H2O,溶液pH上升 ②Fe(OH)3 Fe3+形成Fe(OH)3过程中消耗OH-,使溶液中c(H+)上升,促进I-转化 ③BC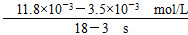 =5.5×10-4 mol/(L·s)
=5.5×10-4 mol/(L·s)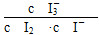 。(3)①第1组实验中,pH升高是因为反应消耗了H+。②图甲中A为Fe(OH)3,由Fe3+生成Fe(OH)3的过程中消耗OH-,溶液中c(H+)增大,促进I-转化,因此I-的转化率显著提高。③导致I3—下降的直接原因是I2(g)不断生成,c(I-)减小。
。(3)①第1组实验中,pH升高是因为反应消耗了H+。②图甲中A为Fe(OH)3,由Fe3+生成Fe(OH)3的过程中消耗OH-,溶液中c(H+)增大,促进I-转化,因此I-的转化率显著提高。③导致I3—下降的直接原因是I2(g)不断生成,c(I-)减小。

科目:高中化学 来源:不详 题型:填空题
 ②镍氢电池的使用可以减少对环境的污染,它采用储氢金属为负极,碱液NaOH为电解液,镍氢电池充电时发生反应 。其放电时的正极的电极反应方程式为 。
②镍氢电池的使用可以减少对环境的污染,它采用储氢金属为负极,碱液NaOH为电解液,镍氢电池充电时发生反应 。其放电时的正极的电极反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.920 kJ | B.557 kJ | C.436 kJ | D.188 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g) △H=—92.4kJ/mol,
2NH3(g) △H=—92.4kJ/mol,| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
 (NH2)2CO +H2O
(NH2)2CO +H2O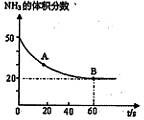
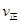 (CO2) B点的逆反应速率
(CO2) B点的逆反应速率 (CO2)(填写“>”“=”或“<”),NH3的平衡转化率为____ ;
(CO2)(填写“>”“=”或“<”),NH3的平衡转化率为____ ; 2NO(g) △H =+180kJ/mol
2NO(g) △H =+180kJ/mol查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
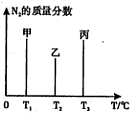
 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。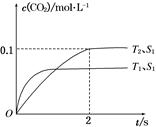

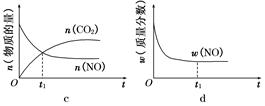
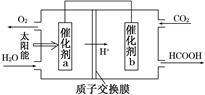
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2012)将于2016年1月1日在我国全面实施。据此,环境空气质量指数(AQI)日报和实时报告包括了SO2、NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
2012)将于2016年1月1日在我国全面实施。据此,环境空气质量指数(AQI)日报和实时报告包括了SO2、NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。| 方法Ⅰ | 用氨水将SO2转化(NH4)2SO3,再氧化成(NH4)2SO4 |
| 方法Ⅱ | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫 |
| 方法Ⅲ | 用Na2SO3溶液吸收SO2,再经电解转化为H2SO4 |
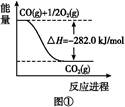
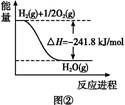

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
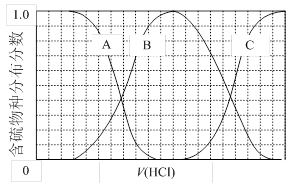
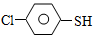 )与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。
)与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。 及X的核磁共振氢谱如下图,其中 (填“Ⅰ”或“Ⅱ”)为
及X的核磁共振氢谱如下图,其中 (填“Ⅰ”或“Ⅱ”)为 的核磁共振氢谱图。写出X的结构简式: 。
的核磁共振氢谱图。写出X的结构简式: 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-74.8 kJ·mol-1 | B.+74.8 kJ·mol-1 |
| C.-211.0 kJ·mol-1 | D.+211.0 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
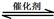 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0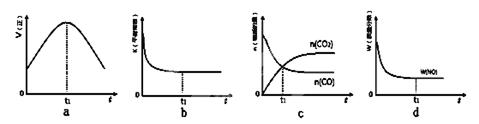
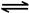 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol 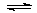 2N2(g) + 3H2O(g)。
2N2(g) + 3H2O(g)。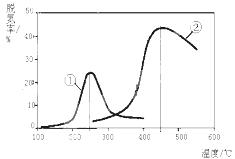
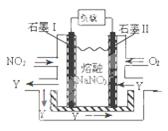
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com