
分析 (1)碳酸钠为强碱弱酸盐,碳酸根离子水解导致溶液呈碱性;
(2)在NaHCO3溶液中,OH-全部来自于水的电离,结合溶液中离子积常数计算水电离出的氢离子浓度判断;溶液中pH=-lgc(H+),而在酸溶液中,氢离子几乎全部来自于酸的电离,但氢氧根全部来自于水的电离,而水电离出的c(H+)等于溶液中c(OH-),据此分析;
(3)欲使平衡向左移动,且所得溶液显酸性,可加入酸或酸性的物质;
(4)一水合氨为弱电解质,不能完全电离,加水促进电离;
(5)溶液中氢离子浓度越大,则其pH越小,按照溶液中氢离子浓度由小到大顺序进行排列.
解答 解:(1)碳酸钠为强碱弱酸盐,钠离子不水解、碳酸根离子水解导致溶液呈碱性,水解离子方程式为:CO32-+H2O?HCO3-+OH-,
故答案为:碱性;CO32-+H2O?HCO3-+OH-;
(2)在NaHCO3溶液中,OH-全部来自于水的电离,由于溶液的pH=11,故溶液中的氢离子浓度为10-11mol/L,由水电离出来的c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-11}}$=1.0×10-3 mol•L-1;
pH等于3的CH3COOH溶液中C(H+)=1.0×10-3mol/L,25℃时:Kw=c(OH-)×c(H+)=10-14,溶液中的c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-3}}$=1.0×10-11mol/L,而在酸溶液中,氢离子几乎全部来自于酸的电离,但氢氧根全部来自于水的电离,故由水电离出的C(H+)=c(OH-)=1.0×10-11mol/L,
故答案为:1.0×10-3;1.0×10-11;
(3)欲使平衡向左移动,且所得溶液显酸性,可加入酸或酸性的物质,
A.向水中加入NaHCO3固体,碳酸氢钠是强碱弱酸盐,水解对水的电离起促进作用,平衡向右移,溶液呈碱性,故A错误;
B.向水中加入NaHSO4固体,溶液于电离出氢离子,平衡向左移,溶液呈酸性,故B正确;
C.加热至100℃,促进水的电离,溶液仍呈中性,故C错误;
D.向水中加入(NH4)2SO4固体,NH4)2SO4是强酸弱碱盐溶液水解呈酸性,水解对水的电离起促进作用,平衡向右移,故D错误;
(4)氨水为弱电解质,不能完全电离,如稀释相等体积,氨水溶液pH大,如稀释后溶液pH相同,则氨水应加入较多水,
故答案为:<;
(5:①NaCl②NaOH③CH3COOH④HCl⑤CH3COONa⑥NaHCO3⑦Ba(OH)2,⑧Na2CO3,
显示碱性的为:②NaOH,⑤CH3COONa,⑥NaHCO3,⑦Ba(OH)2,⑧Na2CO3,Ba(OH)2和氢氧化钠为强碱,⑤CH3COONa⑥NaHCO3⑧Na2CO3为盐,所以pH⑦>②>⑧>⑥>⑤;
显示中性的为①NaCl,pH=7;
显示酸性的为:③CH3COOH④HCl,浓度相同时,盐酸为强酸,氢离子浓度最大,醋酸为一元弱酸,氢离子浓度小于盐酸,溶液的pH大小关系为:③>④,故物质的量浓度相同时,按pH由大到小的顺序为:②>⑦>⑤>①>④>⑥>③,
故答案为:⑦>②>⑧>⑥>⑤>①>③>④.
点评 本题考查了离子浓度大小比较、水的电离及其影响因素、弱电解质的电离平衡等知识,题目难度中等,试题涉及的题量较大,充分考查了学生对所学知识的掌握情况,明确溶液中水电离的氢离子浓度大小的计算方法.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:解答题
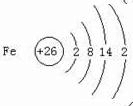 .与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为KOH+HBrO4=KBrO4+H2O.
.与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为KOH+HBrO4=KBrO4+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水与盐酸反应:Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 钠与水的反应:Na+2H2O═Na++2OH-+H2↑ | |
| C. | Na2SiO3溶液中通入过量的CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| D. | 大理石溶于醋酸的反应:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溶液中加入稀盐酸可以促进氨水的电离,溶液的碱性增强 | |
| B. | 向溶液中加入等体积的pH=2盐酸后溶液呈酸性 | |
| C. | 由水电离产生的c(OH-)=10-12mol•L-1 | |
| D. | 向溶液中加入适量盐酸使混合液的pH=7,混合液中c(NH4+)>c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的平均消耗速率为0.3mol(L•min) | |
| B. | C的平衡浓度为2mol/L | |
| C. | 平衡后,增大压强,平衡将向正方向移动 | |
| D. | 若单位时间内生成的B和C的物质的量之比为3:2,则体系处于平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
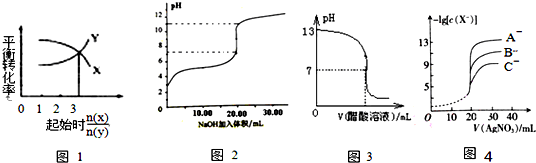
| A. | 一定条件下,X和Y反应生成Z,由图1推出该反应的方程式可表示为:X+3Y?Z | |
| B. | 图2表示NaOH溶液滴加到0.1 mol/L的一元酸溶液得到的滴定曲线(常温下),该实验最好选取酚酞作指示剂 | |
| C. | 常温下,向NaOH溶液中逐滴加入等浓度的醋酸溶液,所得滴定曲线如图3所示.当7<pH<13时,溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均可以与Ag+反应生成沉淀),由图4可确定首先沉淀的是A- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com