
(1) 常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A,根据题意回答下列问题:
①写出酸H2A的电离方程式__________________。
②若溶液M由10mL 2 mol·L-1NaHA溶液与2mol·L-1NaOH溶液等体积混合而得,则溶液M的pH ________7 (填“>”、“<”或“=”),溶液M中各微粒的浓度关系正确的是__________。
A.c(Na+)>c(A2-)>c(OH-)>c(H+)
B.c(HA-)+c(H2A)+c(H+)=c(OH-)
C.c(A2-)+c(HA-)+c(H2A)=1mol·L-1
D.c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+)
(2) CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3
①Na2CO3俗称纯碱,因CO32-水解而使其水溶液呈碱性,试写出CO32-水解的离子方程式(忽略第二步水解)______________,其水解反应的平衡常数(即水解常数)的表达式为Kh=__________。
②已知25℃时,Kh=2×10-4mol/L,则当溶液中c(HCO3-):c(CO32-)=2:1时,试求溶液的pH=__________。
③0.1mol/L Na2CO3溶液中c(OH-)-c(H+)=__________(用含c(HCO3-)、c(H2CO3)的关系式表示)
④向 Na2CO3溶液中加入明矾会产生沉淀和气体,请写出相关的离子方程式__________________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH 的水溶液与 0.2molNO2恰好完全反应得1L溶液A,溶液B为0.1mol·L-1的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为__________。(已知HNO2的电离常数Ka=7.1×10-4mol·L-1,CH3COOH的电离常数Ka=1.7×10-5mol·L-1),可使溶液A和溶液B的pH相等的方法是____________。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(4)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)
n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
①由上表判断NaHSO3溶液显____性,用化学平衡原理解释:______________________。
②当吸收液呈中性时,溶液中出离子浓度关系正确的是(选填字母)_________________。
A.c(Na+)=2c(SO32-)+c(HSO3-)
B.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
C.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
科目:高中化学 来源:2016-2017学年江苏省徐州市高二上第一次月考化学试卷(解析版) 题型:选择题
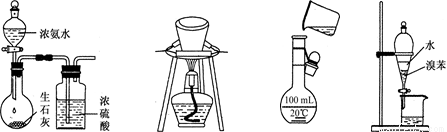
图1 图2 图3 图4
A. 用图1所示装置制取干燥的氨气
B. 用图2所示装置除去碳酸氢钠固体中的少量碳酸钠
C. 用图3所示装置将溶液定容到100 mL
D. 用图4所示装置分离出溴苯
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省新乡市高二上第一次月考化学卷(解析版) 题型:选择题
根据下表的数据,H2(g)+Cl2(g)==2HCl(g)的反应热应为( )
部分物质的键能
H2 | Cl2 | HCl | |
键能(kJ·mol-1) | 436 | 243 | 431 |
A.+183.0 kJ·mol-1 B.-366.0 kJ·mol-1
C.-183.0 kJ·mol-1 D.+211.0 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上半期考试化学卷(解析版) 题型:选择题
1mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:X(g) + aY(g) bZ(g),反应达到平衡后,测得X的转化
bZ(g),反应达到平衡后,测得X的转化 率为50% 。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
率为50% 。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
A.a=l,b=2 B.a=2,b=1 C.a=2,b=2 D.a=3,b=2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上半期考试化学卷(解析版) 题型:选择题
25 ℃时,水的电离达到平衡:H2O H++ OH- ΔH > 0,下列叙述正确的是
H++ OH- ΔH > 0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上第一次月考化学卷(解析版) 题型:选择题
常温下,下列有关电解质溶液的说法正确的是
A.pH=3的强酸溶液1ml,加水稀释至100ml后,溶液pH降低2个单位
B.0.2molCO2通入1L0.3mol·L-1 KOH溶液中:2c(H+)+ c(HCO3-)+ 3c(H2CO3)=2c(OH-)+c(CO32-)
C.已知一定浓度的NaHSO3溶液pH=5.4,则c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-)
D.pH相同的①CH3COONa ②NaHCO3③NaClO三种溶液中的c(Na+):①<②<③
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上第一次月考化学卷(解析版) 题型:选择题
现有两正盐的稀溶液,分别是a mol/L NaX溶液和b mol/L NaY溶液。下列说法不正确的是
A.若a>b,测得c(X-)=c(Y-),可推出溶液中的c(HX)>c(HY)
B.若a>b,测得c(X-)=c(Y-),可推出溶液中的c(HX)=c(HY)
C.若a=b,且pH(NaX)>pH(NaY),则浓度相同时,酸性HX<HY
D.若a=b,并测得 a=c(X-)=c(Y-)+c(HY),则HX是强酸,HY是弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
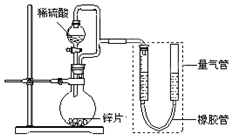 某同学设计了如图所示装置(部分夹持装置已略去),该装置可以用来进行多项实验研究.
某同学设计了如图所示装置(部分夹持装置已略去),该装置可以用来进行多项实验研究.| 序号 | V(H2SO4)/mL | c(H2SO4)/mol•L-1 | t/s |
| Ⅰ | 40 | 1 | t1 |
| Ⅱ | 40 | 4 | t2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2与Fe粉完全反应时转移电子数为2NA | |
| B. | 过氧化钠与水反应时,每生成1molO2,转移4mol电子 | |
| C. | 标准状况下,11.2L氟化氢中含有氟原子的数目为0.5NA | |
| D. | 0.1 mol•L-1NaHSO4溶液中,阳离子数目之和为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com