
| A、溶液中所含溶质的离子浓度大小关系为:c(NO3-)>c(K+)>c(Cl-)>c(I-)>c(Ag+) |
| B、溶液中先产生的是AgI沉淀 |
| C、AgCl的KSP的数值为1.69×10-10 |
| D、若在AgI悬浊液中滴加KCl溶液,黄色沉淀可能转变成白色沉淀 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
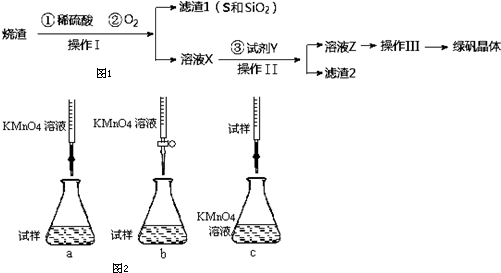
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/min | 0 | 2 | 4 | 6 | 8 | … | 16 | 18 |
| n(X)/mol | 1.600 | 1.200 | 1.100 | 1.075 | … | … | 1.000 | 1.000 |
| A、4~6min时间段内Z的平均反应速率为2.5×10-3mol/(L?min) | ||
| B、此温度下该反应的平衡常数K=1.44 | ||
C、达平衡后,升高温度,
| ||
| D、若保持其他条件不变,再充入1.6mol Z,达新平衡后Z的体积分数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
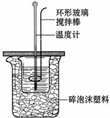
| A、烧杯间填满碎泡沫塑料是减少实验过程中的热量损失 |
| B、使用环形玻璃棒既可以搅拌又避免损坏温度计 |
| C、向盛装酸的烧杯中加碱时要小心缓慢 |
| D、测定酸后的温度计要用蒸馏水清洗干燥后再测碱的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
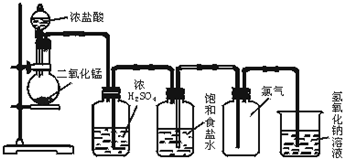
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、钾(K)原子基态的原子结构示意图为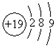 |
B、H2O电子式为 |
| C、Mg的原子基态电子排布式为1s22s22p63s23p1 |
| D、Ca2+离子基态电子排布式为1s22s22p63s23p6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
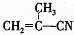 ,②
,②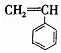 ,③
,③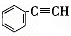 ,④CH3-CH=CH-CN,其中可用于合成
,④CH3-CH=CH-CN,其中可用于合成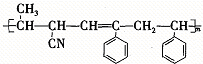 结构简式为的高分子材料的正确组合为( )
结构简式为的高分子材料的正确组合为( )| A、①③④ | B、①②③ |
| C、①②④ | D、②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com