
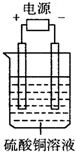
 如图电解池中装有硫酸铜溶液,选用不同的、材料的电极进行电解.下列说法正确的是( ) 如图电解池中装有硫酸铜溶液,选用不同的、材料的电极进行电解.下列说法正确的是( )
| ||||||||||||||||||||||
| ||


科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| 温度 | 10℃ | 20℃ | 30℃ | 40℃ |
| 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
| 碳酸氢铵 | 15.8 | 21.0 | 27.0 | 分解 |
| 碳酸氢钠 | 8.1 | 9.6 | 11.1 | 12.7 |
| 氯化铵 | 33.3 | 37.2 | 41.4 | 45.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
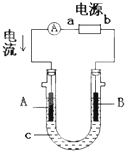 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直  流电源相连。请回答以下问题:
流电源相连。请回答以下问题:
(1)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则① X电极的材料是 ,电极反应式是 。
② Y电极的材料是 , 电极反应式是 。(说明:杂质发生的电极反应不必写出)
(2)若电解液a选用AgNO3溶液, X和Y电极的材料均为Cu,则X电极上的电极反应式是 。一段时间后,若X和Y两个电极质量相差14g,则在该过程中转移的电子数为 mol
(3)如右图所示的装置,甲装置中的电解质溶液为硫酸铜溶液,乙中为稀硫酸,请按以下要求回答问题。
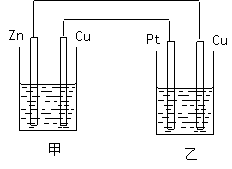 ①在这两个装置中,甲装置是 (原电池或电解池),甲中铜电极上的电极反应为
①在这两个装置中,甲装置是 (原电池或电解池),甲中铜电极上的电极反应为
________ ,乙中铜电极上的电极反应为 。
②反应开始一段时间后,甲中锌极质量减少6.5克,此时乙中两极收集到的气体在标准状况下的总体积为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜,其工作原理如图所示。
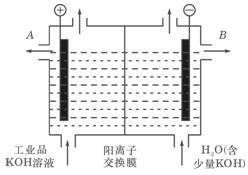
①该电解槽的阳极反应式是: 。
②除去杂质后的氢氧化钾溶液从液体出口____(填写“A”或“B”)导出。
(2)如图,有一综合电解装置,A、B、C均为0.1L 1mol/L溶液,通电一段时间后,B池溶液质量增加6.3 g,试回答:
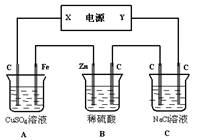
①C 池阳极放出气体在标准状况下的体积为 L ;
②A 池要恢复溶液组成,可加入 mol ;
③若电源为铅蓄电池,电极材料分别为铅和二氧化铅,以硫酸作电解质溶液,则Y极电极反应式为 ,X极质量 (填“增大”或“减小”) g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com