
 2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.
2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
分析 (1)①化学平衡常数K=$\frac{生成物浓度系数幂次方}{反应物浓度系数幂次方}$;
②当正逆反应速率相等、各组分浓度保持不变时,反应达到平衡状态,据此判断;
(2)①根据到达平衡的时间判断温度高低,根据平衡时二氧化碳的浓度判断温度对平衡的影响;
②若催化剂的表面积S1>S2,由增大其表面积可提高化学反应速率,故T2、S2条件下到达平衡时间比T2、S1的时间更长,但不影响化学平衡移动,平衡时二氧化碳的浓度不变;
(3)①依据计算浓度商和该温度下的平衡常数比较分析判断反应进行方向;
②温度、体积不变的可逆反应中,气体的压强之比等于其物质的量之比,据此计算反应后气体体积的物质的量,从而计算氢气反应的物质的量,再根据v=$\frac{△c}{△t}$计算反应速率;根据平衡时CO反应的物质的量结合转化率=$\frac{消耗量}{起始量}$×100%计算其转化率.
解答 解:(1)①化学平衡常数K=$\frac{生成物浓度系数幂次方}{反应物浓度系数幂次方}$,则2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)平衡常数表达式为:K=$\frac{[CH{\;}_{3}OCH{\;}_{3}]•[H{\;}_{2}O]{\;}^{3}}{[CO{\;}_{2}]{\;}^{2}•[H{\;}_{2}]{\;}^{6}}$,故答案为:K=$\frac{[CH{\;}_{3}OCH{\;}_{3}]•[H{\;}_{2}O]{\;}^{3}}{[CO{\;}_{2}]{\;}^{2}•[H{\;}_{2}]{\;}^{6}}$;
②A.恒容容器中,体积不变,据质量守恒定律,反应前后气体质量不变,密度始终不变,所以容器中密度不变不能说明反应达到平衡状态,故A错误;
B.单位时间内消耗2molCO2,同时消耗1mol二甲醚,说明正逆反应速率相等,反应达到平衡状态,故B正确;
C.v(CO2):v(H2)的比值,无论正向进行、逆向进行还是平衡时正逆向进行,始终与化学计量数相同为1:3,所以v(CO2):v(H2)=1:3不能说明正逆反应速率相等,不能证明反应达到平衡状态,故C错误;
D.该反应前后气体体积不等,所以容器内压强保持不变,说明各组分浓度不变,反应达到平衡状态,故D正确;
故答案为:BD;
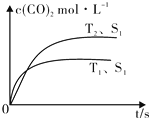
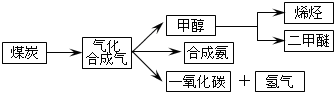
(2)①由图可知,温度T1先到达平衡,故温度T1>T2,温度越高平衡时,二氧化碳的浓度越低,说明升高温度平衡向逆反应移动,故正反应为放热反应,所以△H<0,故答案为:放热;<;
②若催化剂的表面积S1>S2,由增大其表面积可提高化学反应速率,故T2、S2条件下到达平衡时间比T2、S1的时间更长,但不影响化学平衡移动,平衡时二氧化碳的浓度不变,在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线为: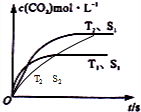 ,
,
故答案为: ;
;
(3)①250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4mol•L-1、c(H2)=0.4mol•L-1、c(CH3OH)=0.8mol•L-1,浓度商Q=$\frac{0.8mol/L}{0.4mol/L×(0.4mol/L){\;}^{2}}$=12.5>K=2.041,说明反应逆向进行v正<v逆;
故答案为:<;
②温度、体积不变的可逆反应中,气体的压强之比等于其物质的量之比,15min,压强比(P后/P前)=0.80,则反应后气体的物质的量=3mol×0.80=2.40mol,气体减少的物质的量=3mol-2.4mol=0.6mol,根据CO(g)+2H2(g)?CH3OH(g)气体减少的物质的量等于氢气的物质的量,参加反应的氢气的物质的量0.6mol,0~15min,用H2表示的平均反应速率=$\frac{\frac{0.6mol}{2L}}{15min}$=0.02 mol•( L•min)-1;
平衡状态压强比(P后/P前)=0.70,则反应后气体的物质的量=3mol×0.70=2.10mol,气体减少的物质的量=3mol-2.1mol=0.9mol,根据CO(g)+2H2(g)?CH3OH(g)气体减少的物质的量等于氢气的物质的量,所以参加反应的CO的物质的量$\frac{0.9mol}{2}$=0.45mol,则CO的转化率=$\frac{0.45mol}{1mol}$×100%=45%,
故答案为:0.02 mol•( L•min)-1;45%.
点评 本题考查了平衡状态的判断、平衡移动原理、化学反应速率、平衡常数概念的理解应用,化学平衡的计算分析是关键,气体压强压强之比等于物质的量之比,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间 | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/mol•L-1 | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(Y)/mol•L-1 | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol•L-1) | 0.8 | 1.24 | 1.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
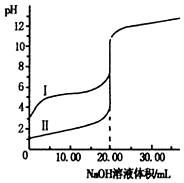 室温下,用0.1mol•L-1 NaOH溶液分别滴定20.00ml0.1mol•L-1的盐酸和醋酸溶液,滴定曲线如图.下列说法正确的是( )
室温下,用0.1mol•L-1 NaOH溶液分别滴定20.00ml0.1mol•L-1的盐酸和醋酸溶液,滴定曲线如图.下列说法正确的是( )| A. | I、Ⅱ分别表示盐酸和醋酸的滴定曲线 | |
| B. | V(NaOH)=10.00mL时,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$>1 | |
| C. | pH=7时,两种酸所消耗NaOH溶液的体积相等 | |
| D. | V(NaOH)=20.00mL时,c(Cl一)<c(CH3COO一) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com