
【题目】用石墨作电极电解KCl和CuSO4(等体积混合)混合溶液,电解过程中溶液pH随时间t的变化如图所示,下列说法正确的是
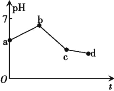
A.ab段H+被还原,溶液的pH增大
B.原溶液中KCl和CuSO4的物质的量浓度之比为2∶1
C.c点时加入适量CuCl2固体,电解液可恢复原来浓度
D.cd段相当于电解水
【答案】D
【解析】
用惰性电极电解相等体积的KCl和CuSO4混合溶液,溶液中存在的离子有:K+,Cl-,Cu2+,SO42-,H+,OH-;阴极离子放电顺序是Cu2+>H+,阳极上离子放电顺序是Cl->OH-,电解过程中分三段:第一阶段:阳极上电极反应式为2Cl--2e-═Cl2↑、阴极电极反应式为Cu2++2e-═Cu,铜离子浓度减小,水解得到氢离子浓度减小,溶液pH上升;第二阶段:阳极上电极反应式为4OH--4e-═2H2O+O2↑(或2H2O-4e-═4H++O2↑),阴极反应先发生Cu2++2e-═Cu,反应中生成硫酸,溶液pH降低;第三阶段:阳极电极反应式为4OH--4e-═2H2O+O2↑、阴极电极反应式为2H++2e-═H2↑,实质是电解水,溶液中硫酸浓度增大,pH继续降低;据此分析解答。
A. ab段阴极电极反应式为Cu2++2e-═Cu,由于铜离子浓度减小,水解得到氢离子浓度减小,溶液pH上升,氢离子未被还原,故A错误;
B. 由图像可知,ab、bc段,阴极反应都是Cu2++2e-═Cu,所以原混合溶液中KCl和CuSO4的浓度之比小于2:1,故B错误;
C. 电解至c点时,阳极有氧气放出,所以往电解液中加入适量CuCl2固体,不能使电解液恢复至原来的浓度,故C错误;
D. cd段pH降低,此时电解反应参与的离子为H+,OH-,电解反应相当于电解水,故D正确;
选D。


科目:高中化学 来源: 题型:
【题目】Si元素在地壳中含量较高,用其单质或化合物生产的计算机芯片、光导纤维、超硬材料、干燥剂等具有广泛的应用。请回答下列问题:
(1) Si原子核外有3个电子层,所以Si位于元素周期表的第____周期。
(2) Si与C同属于第![]() 族元素,但Si的原子半径比C的___(填“大”或“小”)。
族元素,但Si的原子半径比C的___(填“大”或“小”)。
(3) SiC中![]() 元素显正价,所以Si的非金属性比C的____(填“强”或“弱”)。
元素显正价,所以Si的非金属性比C的____(填“强”或“弱”)。
(4) Si元素最高价氧化物对应的水化物是一种酸,其化学式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
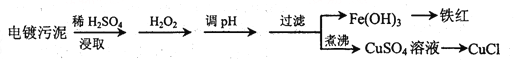
【题目】某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.3 | 7.6 | 4.4 |
完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(1)酸浸后加入H2O2的目的是________________,调pH的最适宜范围为________________。
(2)调pH过程中加入的试剂最好是___________。
A. NaOH B. CuO C.NH3·H2O D.HCl
(3)煮沸CuSO4溶液的原因是_________。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式_________。
(4)过滤后的沉淀表面通常附着有一些杂质离子,为得到纯净产物,需要进行洗涤,确定沉淀洗涤干净的操作及现象是_________。
(5)称取所制备的CuCl样品0.2500g置于一定量的0.5mol·L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000 mol·L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液25.00mL。有关的化学反应为Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+。计算该CuCl样品的质量分数__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有对四种元素的叙述如下:
①元素X的基态原子的价电子排布式3s23p1
②元素Y的基态原子的原子结构示意图![]()
③元素Z的基态原子Z3-的轨道表示式![]()
④元素T的基态原子有两个电子层,电子式为![]()
则下列有关比较中正确的是( )
A.第一电离能:T>Z>X>Y
B.简单离子半径:Z>T>Y>X
C.电负性:Z>T>Y>X
D.最高正化合价:T>Z>X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予锂离子电池的发明者,LiFePO4是锂离子电池的正极材料。用含锂废渣(主要金属元素的含量:Li 8.50%、Ni 6.55%、Mg 13.24%)制备Li2C2O4,并用其制备LiFePO4部分工艺流程如图(该流程可能造成水体砷污染):
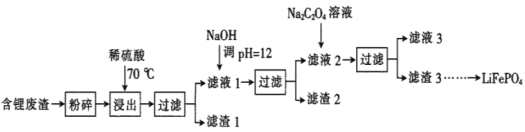
已知:滤液1、滤液2中部分离子的浓度(g·L-1):
Li+ | Ni2+ | Mg2+ | |
滤液1 | 22.72 | 20.68 | 60.18 |
滤液2 | 21.94 | 7.7×10-3 | 0.78×10-3 |
I.制备Li2C2O4
(1)滤渣2的主要成分有__(填化学式)。
(2)Na2C2O4溶液中各离子的浓度由大到小顺序为__。
(3)写出加入Na2C2O4溶液时发生反应的离子方程式:__。
Ⅱ.制备LiFePO4
(4)将电池极Li2C2O4和FePO4置于高温下反应生成LiFePO4和一种温室气体,该反应的化学方程式是___。
(5)LiFePO4需要在高温下成型后才能作为电极,高温成型时要加入少量石墨,则石墨的作用是__(任写一点)。
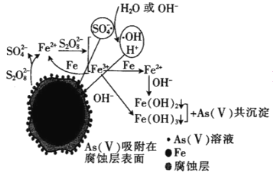
(6)我国科学家研究零价铁活化过硫酸钠(Na2S2O8)去除废水中的As(Ⅴ),其机制模型如图,其中零价铁与过硫酸钠反应的离子方程式是__。在该模型中得到的铁砷共沉淀物经灼烧(无元素化合价变化)后得到一种磁性化合物,化学式为Fe7As2O14,该物质中二价铁与三价铁的个数比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)在不同条件下分解产物不同,200℃时在Cu表面分解的机理如图。已知200℃时:反应Ⅰ:3N2H4(g)=N2(g)+4NH3(g) ΔH1=-32.9 kJ·mol-1反应Ⅱ:N2H4(g)+H2(g)2NH3(g)ΔH2=-41.8 kJ·mol-1
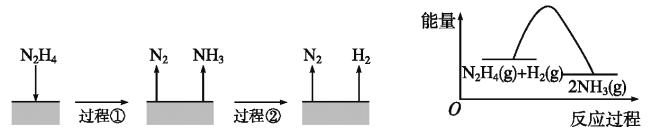
下列说法不正确的是()
A. 图所示过程①是放热反应
B. 反应Ⅱ的能量过程示意图如图所示
C. 断开3 mol N2H4(g)的化学键吸收的能量大于形成1 molN2(g)和4 mol NH3(g)的化学键释放的能量
D. 200℃时,肼分解生成氮气和氢气的热化学方程式为N2H4(g)=N2(g)+2H2(g)ΔH=+50.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯氧布洛芬具有良好的解热、镇痛、抗炎、抗风湿作用,苯氧布洛芬的合成路线如下:
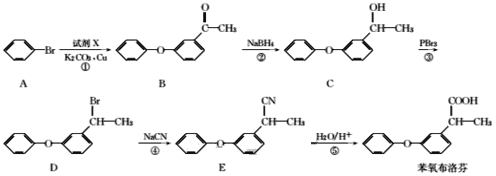
回答下列问题:
(1)苯氧布洛芬中官能团的名称为___。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。A-D四种物质中,含有手性碳的有机物为___(填字母)。
(3)反应②的反应类型是___。
(4)若过程①发生的是取代反应,且另一种产物为HBr,由A生成B发生反应的化学方程式为___。
(5)有机物M与C互为同分异构体,M满足下列条件:
I.能与FeCl3溶液发生显色反应,1molM可消耗2molNaOH;
Ⅱ.M分子中有6种不同化学环境的氢,核磁共振氢谱为3:2:2:2:2:3,且分子中含有![]() 结构。
结构。
M的结构有___种,写出其中一种结构简式:___。
(6)根据已有知识并结合相关信息,写出以丙酮(CH3COCH3)为原料制备2一甲基丙酸的合成路线流程图(无机试剂任用)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述中,正确的是( )
A.Na、Mg、Al的未成对电子数依次增多
B.价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素
C.2p和3p轨道形状均为哑铃形,能量也相等
D.氮原子的最外层电子排布图:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应C(s)+CO2(g)![]() 2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示:
2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示:
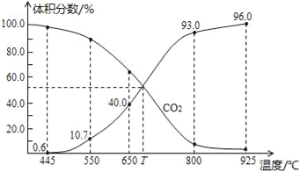
已知气体分压(P分)=气体总压(P总)×体积分数,下列说法不正确的是
A.550℃时,若充入惰性气体,v正,v逆均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向不移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=23.04P总
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com