
 对叔丁基苯酚(
对叔丁基苯酚( )工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯等为原料制备对叔丁基苯酚.
)工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯等为原料制备对叔丁基苯酚. .
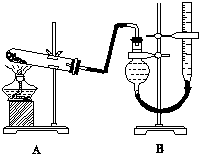
.分析 (1)根据实验装置图可知仪器名称;
(2)该反应是苯酚、叔丁基氯生成产品的反应,从结构上分析为取代反应,据此写方程式;
(3)反应产生极易溶解于水的HCl,且反应温度较高,故用倒扣的漏斗防止倒吸;苯酚易溶于酒精;
(4)根据仪器使用规则,容量瓶、滴定管、分液漏斗在使用前都必须检漏;
(5)根据反应 可计算出对叔丁基苯酚的理论产量,再根据产率=$\frac{实际产量}{理论产量}$×100%计算.
可计算出对叔丁基苯酚的理论产量,再根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:(1)根据实验装置图可知仪器X为三颈(口)烧瓶,
故答案为:三颈(口)烧瓶;
(2)该反应是苯酚、叔丁基氯生成产品的反应,从结构上分析为取代反应,反应方程式为 ,
,
故答案为: ;
;
(3)反应产生极易溶解于水的HCl,且反应温度较高,故用倒扣的漏斗防止倒吸;苯酚以溶于酒精,所以苯酚沾到皮肤上可用酒精洗涤,
故答案为:防止倒吸;酒精;
(4)根据仪器使用规则,容量瓶、滴定管、分液漏斗在使用前都必须检漏,故选BCD,
故答案为:BCD.
(5)根据反应:
94 150
1.6g x
x=$\frac{1.6×150}{94}$=2.55g,
则对叔丁基苯酚的产率为$\frac{1.8g}{2.55g}$×100%=70.6%;
故答案为:70.5%.
点评 本题有机物的合成为载体,考查化学实验,题目综合性较大,涉及对实验原理的理解、对装置的分析评价、对实验条件的选择控制、实验方案设计、物质分离提纯、化学计算等,难度中等,是对学生综合能力的考查.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝箔插入稀HNO3中,无现象,说明铝箔表面被HNO3氧化,形成致密的氧化膜 | |
| B. | 加入铝粉能产生H2的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3- | |
| C. | 明矾可用于水的消毒,杀菌 | |
| D. | 向NaAlO2溶液中通入过量CO2的离子方程式为2AlO${\;}_{2}^{-}$+CO2+3H2O═2Al(OH)3↓+CO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:| 实验序号 | KClO3质量 | 其他物质质量 | 待测数据 |
| ④ | 1.2g | 无其他物质 | |
| ⑤[ | 1.2g | CuO 0.5g | |
| ⑥ | 1.2g | MnO2 0.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 聚合硫酸铁铝(PFAS)是一种新型高效水处理剂.利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源,粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为铝源,制备PFAS的工艺流程如图:
聚合硫酸铁铝(PFAS)是一种新型高效水处理剂.利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源,粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为铝源,制备PFAS的工艺流程如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mol | B. | 11 mol | C. | 12 mol | D. | 13 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| 选项 | a中的物质 | b中的物质 | c中的物质 | d中的物质 | d中的物质 |
| A | 浓硫酸 | 铜片 | 品红溶液 | 酸性高锰酸钾溶液 | c,d中溶液颜色均褪色,依次体现SO2漂白性和还原性 |
| B | 浓硫酸 | 蔗糖 | 紫色石蕊溶液 | NaOH溶液 | c中溶液变红色,不能判断是SO2的作用 |
| C | 稀硝酸 | Cu | 收集NO2 | H2O | d中反应每消耗3mol氧化剂,转移2mol电子 |
| D | 浓氨水 | 碱石灰 | 收集NH3 | 稀H2SO4 | d中反应产物可作肥料 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、MnO4-、K+、NO3-SO32- | B. | Na+、S2-、SO32-、H+、NO3- | ||
| C. | Na+、S2-、OH-、K+、Cl- | D. | HCO3-、H+、Na+、Ca2+ SO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com