
| A. | 酸性氧化物:CO2、SiO2、SO2、NO2 | |
| B. | 碱:烧碱、纯碱、苛性钾、氢氧化钡 | |
| C. | 混合物:盐酸、漂白粉、水煤气、氢氧化铁胶体 | |
| D. | 碱性氧化物:Na2O、CaO、MgO、Al2O3 |
分析 A、能和碱反应生成盐和水的氧化物为酸性氧化物;
B、电离出的阴离子全部是氢氧根的化合物为碱;
C、由两种或以上物质构成的是混合物;
D、能和酸反应生成盐和水的氧化物为碱性氧化物.
解答 解:A、能和碱反应生成盐和水的氧化物为酸性氧化物,NO2和碱反应除了生成盐和水,还生成NO,故不是酸性氧化物,故A错误;
B、电离出的阴离子全部是氢氧根的化合物为碱,而纯碱为碳酸钠,是盐不是碱,故B错误;
C、由两种或以上物质构成的是混合物,盐酸是HCl的水溶液,是混合物;漂白粉是氯化钙和次氯酸钙的混合物;水煤气是CO和氢气的混合物;氢氧化铁胶体是分散系,是混合物,故C正确;
D、能和酸反应生成盐和水的氧化物为碱性氧化物,而氧化铝既能和酸反应又能和碱反应生成盐和水,故为两性氧化物,故D错误.
故选C.
点评 本题考查了酸性氧化物、碱性氧化物、碱和混合物的概念,把握概念的要点是解题关键,难度不大.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | Al3+、Na+、NO3-、Cl- | B. | K+、Na+、Cl-、HCO3- | ||
| C. | Ba2+、Na+、Cl-、NO3- | D. | K+、NH4+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 验证NH3给合H+的能力强于Ag+:向含有NaCl的银氨溶液中滴入过量稀硝酸,观察现象 | |
| B. | 检验某酸雨中是否含有SO42-:向酸雨试样中加入盐酸酸化的Ba(NO3)2溶液,观察现象 | |
| C. | 配制FeCl2溶液:将FeCl2溶于较浓盐酸中,然后加适量水稀释,再向配制好的溶液中加入几枚光亮的铁钉 | |
| D. | 提纯含有少量苯的苯酚:向含有少量苯的苯酚混合物中加入NaOH溶液充分振荡,静置分液;在水相中再通入足量CO2,再静置分液,取有机相-苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇分子的比例模型: | |
| B. | 蔗糖、麦穿糖、淀粉、纤维素充全水解都只生成葡萄糖 | |
| C. | 《天工开物》中“凡石灰,经火焚炼为用”里的“石灰”指的是Ca(OH)2 | |
| D. | 许多国家十分重视海水资源的综合利用,从海水中可获得的物质有氧、溴、碘、钠、镁、铝、烧碱、氢气、食盐、淡水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②④ | C. | ①③④⑤ | D. | ② |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
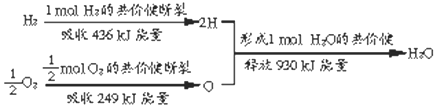
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com