
纽扣电池可用于计算器、电子表等的电源。有一种纽扣电池,其电极分别为Zn和Ag2O,以KOH溶液为电解质溶液,电池的总反应为Zn+Ag2O+H2O 2Ag+Zn(OH)2。关于该电池的叙述不正确的是( )
2Ag+Zn(OH)2。关于该电池的叙述不正确的是( )

A.使用时电子由Zn极经外电路流向Ag2O极,Zn是负极
B.使用时电子由Ag2O极经外电路流向Zn极,Ag2O是负极
C.正极的电极反应为Ag2O+2e-+H2O 2Ag+2OH-
2Ag+2OH-
D.Zn极发生氧化反应,Ag2O极发生还原反应
科目:高中化学 来源:2014年高二化学人教版选修四 4化学反应热的计算练习卷(解析版) 题型:填空题
把煤作为燃料可通过下列两种途径:
途径Ⅰ C(s)+O2(g) CO2(g) ΔH1<0①
CO2(g) ΔH1<0①
途径Ⅱ 先制成水煤气:
C(s)+H2O(g) CO(g)+H2(g) ΔH2>0②
CO(g)+H2(g) ΔH2>0②
再燃烧水煤气:
2CO(g)+O2(g) 2CO2(g) ΔH3<0③
2CO2(g) ΔH3<0③
2H2(g)+O2(g) 2H2O(g) ΔH4<0④
2H2O(g) ΔH4<0④
请回答下列问题:
(1)途径Ⅰ放出的热量理论上 (填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
(2)ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是 。
(3)已知:①C(s)+O2(g) CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g) ΔH1=-393.5 kJ·mol-1
②2CO(g)+O2(g) 2CO2(g) ΔH2=-566 kJ·mol-1
2CO2(g) ΔH2=-566 kJ·mol-1
③TiO2(s)+2Cl2(g) TiCl4(s)+O2(g) ΔH3=+141 kJ·mol-1
TiCl4(s)+O2(g) ΔH3=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s) TiCl4(s)+2CO(g)的ΔH= 。
TiCl4(s)+2CO(g)的ΔH= 。
(4)已知下列各组热化学方程式
①Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1
2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1
②3Fe2O3(s)+CO(g) 2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1
2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1
③Fe3O4(s)+CO(g) 3FeO(s)+CO2(g) ΔH3=+640 kJ·mol-1
3FeO(s)+CO2(g) ΔH3=+640 kJ·mol-1
请写出FeO(s)被CO(g)还原成Fe和CO2(g)的热化学方程式 ______________________。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 21电解原理练习卷(解析版) 题型:选择题
若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的离子方程式是Cu+2H+ Cu2++H2↑,则下列关于该装置的有关说法中正确的是( )
Cu2++H2↑,则下列关于该装置的有关说法中正确的是( )
A.该装置可能是原电池,也可能是电解池
B.该装置只能是原电池,且电解质溶液为硝酸
C.该装置只能是电解池,且金属铜为该电解池的阳极
D.该装置只能是原电池,电解质溶液不可能是盐酸
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 1化学反应与能量的变化练习卷(解析版) 题型:选择题
化学反应N2+3H2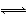 2NH3的能量变化如图所示,该反应的热化学方程式是( )
2NH3的能量变化如图所示,该反应的热化学方程式是( )
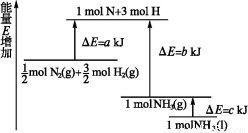
A.N2(g)+3H2(g) 2NH3(l) ΔH=2(a-b-c)kJ·mol-1
2NH3(l) ΔH=2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g) 2NH3(g) ΔH=2(b-a)kJ·mol-1
2NH3(g) ΔH=2(b-a)kJ·mol-1
C.N2(g)+H2(g) NH3(l) ΔH=(b+c-a)kJ·mol-1
NH3(l) ΔH=(b+c-a)kJ·mol-1
D.N2(g)+H2(g) NH3(g) ΔH=(a+b)kJ·mol-1
NH3(g) ΔH=(a+b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 19一次电池 二次电池练习卷(解析版) 题型:选择题
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(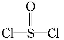 )中而形成的,电池总反应方程式为:8Li+3SOCl2
)中而形成的,电池总反应方程式为:8Li+3SOCl2 6LiCl+Li2SO3+2S,下列叙述中正确的是( )
6LiCl+Li2SO3+2S,下列叙述中正确的是( )
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的正极,石墨作电池的负极
C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4∶1
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 18原电池练习卷(解析版) 题型:选择题
将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加少量的CuSO4溶液,如各图中产生H2的体积V(L)与时间t(min)的关系,正确的是( )
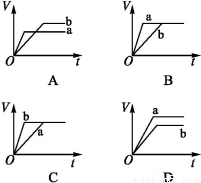
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 17难溶电解质的溶解平衡练习卷(解析版) 题型:填空题
(1)在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 。已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,= 。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 16盐类水解的应用练习卷(解析版) 题型:选择题
在蒸发皿中加热蒸干并灼烧(低于400 ℃)下列物质的溶液,可以得到该固体物质的是( )
A.氯化铝B.碳酸氢钠C.硫酸镁D.高锰酸钾
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 11弱电解质的电离练习卷(解析版) 题型:填空题
下表是几种常见弱酸的电离平衡常数(25 ℃)。
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | 1.76×10-5 |
H2CO3 | H2CO3 HCO3— | K1=4.4×10-7 K2=4.7×10-11 |
H2S | H2S HS- | K1=1.3×10-7 K2=7.1×10-15 |
H3PO4 | H3PO4 H2PO4— HPO42— | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
回答下列问题:
(1)当温度升高时,K值 (填“增大”“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?
。
(3)若把CH3COOH、H2CO3、HCO3—、H2S、HS-、H3PO4、H2PO4—、HPO42—都看成是酸,其中酸性最强的是 ,最弱的是 。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着一定的规律,此规律是 ,产生此规律的原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com