
【题目】如下图所示,△H1=-393.5 kJmol-1,△H2=-395.4 kJmol-1,下列说法或表示式正确的是
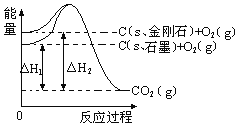
A. 石墨和金刚石的转化是物理变化
B. C(s、石墨)="=" C(s、金刚石) △H=" +1.9" kJmol-1
C. 金刚石的稳定性强于石墨
D. 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】材料的应用和发展与人类文明的进步紧密相关,下列关于材料的说法正确的是( )
A.普通玻璃是合成材料B.玻璃钢是无机非金属材料
C.有机玻璃是一种常见的塑料D.有机玻璃是复合材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
A. NH4Cl+NaOH=NaCl+NH3![]() +H2O B. Mg3N2+6H2O=3Mg(OH)2+2NH3
+H2O B. Mg3N2+6H2O=3Mg(OH)2+2NH3![]()
C. Cl2+2NaOH=NaClO+NaCl+H2O D. 2Na2O2+2H2O=NaOH+O2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应A2(g)+B2(g)![]() 2AB(g) 达到平衡状态的标志是( )
2AB(g) 达到平衡状态的标志是( )
A. 单位时间内生成n mol A2的同时,生成n mol的AB
B. 单位时间内生成2n mol AB的同时,生成n mol的B2
C. 单位时间内,生成n mol A2的同时,生成n mol的B2
D. 容器内的总压强不随时间而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是( )
A. 将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水
B. 向氨水中加入浓氢氧化钠溶液,加热产生使湿润的红色石蕊试纸变蓝的气体,说明氨水中含有NH4+
C. 加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3具有热不稳定性
D. 将红热的Pt丝伸入如图所示的锥形瓶中,瓶口出现少量的红棕色气体,说明氨气催化氧化的产物中有NO
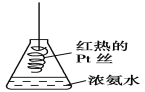
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲测定室温下(25 ℃、101 kPa)的气体摩尔体积,请回答以下问题。该小组设计的简易实验装置如下图所示:

该实验的主要操作步骤如下:
步骤一:
(1)①配制100 mL 1.0 mol·L-1的盐酸,需要20%,密度为1.1g·cm-3的盐酸的体积为______。
②配制过程中所需要的玻璃仪器有__________________________________________。
③下列操作会导致物质的量浓度偏大的是_________________
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容
B.在容量瓶中进行定容时仰视刻度线
C.在容量瓶中进行定容时俯视刻度线
D.定容后把容量瓶倒置摇匀,发现液面低于刻度线,又补足了所缺的水
步骤二: 用量筒量取出10.0 mL 1.0 mol·L-1的盐酸加入锥形瓶中;
步骤三: (2)称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为________;
步骤四: 往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
步骤五: (3)反应结束后待体系温度恢复至室温,读取量筒中水的体积为V mL。
①实验步骤五中应选用________(填序号)的量筒。
A.100 mL B.200 mL C.500 mL
②读数时除恢复到室温,视线与液体凹液面的最低处相平外,还要注意_____________________。
③若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算公式为Vm=________,若未除去镁条表面的氧化膜,则测量结果________(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁在生产和生活中有着广泛的应用。某研究性学习小组设计了如下图所示装置探究钢铁的腐蚀与防护。

在相同条件下,三组装置中铁电极腐蚀最快的是_____________(填装置序号),该装置中正极电极反应式为___________________________;为防止金属Fe被腐蚀,效果最好的为上述的_____________(填装置序号)装置原理进行防护;装置③中总反应的离子方程式为__________________________________________________。
(2)燃料电池作为新型电池,越来越多地应用于日常生活,该学习小组设计了以下电池:将两个多孔的石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成燃料电池。其中通入CH4的电极是电极反应式___________________________________,电池工作期间,OH-应向_______极移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列一定属于放热反应的是( )
A. 不需要加热就能发生的反应
B. 拆开反应物所有化学键吸收的能量小于生成物化学键形成时释放的能量
C. 反应物总能量小于生成物总能量
D. NaOH固体溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液能用来区分SO2和CO2气体的是
①澄清的石灰水 ②氢硫酸 ③溴水 ④酸性高锰酸钾溶液 ⑤品红溶液
A. ③⑤ B. ②③⑤ C. ②③④⑤ D. 全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com