
| A. | 甲烷与氯气混合后光照发生反应 | B. | 乙炔与氯气的加成反应 | ||
| C. | 乙烯与氯化氢的加成反应 | D. | 二氧化碳通入石灰水中 |
分析 A.甲烷光照下的取代反应为连锁式反应;
B.乙炔中含碳碳三键,氯气的量不同,产物不同;
C.乙烯与氯化氢只能以1:1加成;
D.根据石灰水和少量CO2反应的产物是碳酸钙和水,与过量CO2反应的产物是碳酸氢钙.
解答 解:A.甲烷与Cl2在光照条件下发生取代反应可得到各种氯代产物和氯化氢,故A不选;
B.乙炔与Cl2加成反应可以得到CHCl═CHCl或CHCl2CHCl2,故B不选;
C.乙烯与氯化氢以1:1加成,只有一种氯乙烷,故C选;
D.石灰水和少量CO2反应的产物是碳酸钙和水,与过量CO2反应的产物是碳酸氢钙,故D不选.
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握有机反应中官能团变化、结构变化判断反应类型为解答的关键,侧重分析与应用能力及有机反应类型的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

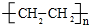 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 | B. | 0.2 mol•L-1 | C. | 0.4 mol•L-1 | D. | 0.8 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH4Cl溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | (NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+) | |
| C. | Na2CO3溶液:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | |
| D. | NaHCO3溶液:c(H+)+c(H2CO3)=c(OH-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol丙烯酸中含有双键的数目为0.1NA | |
| B. | 常温常压下,Cu、Zn、稀硫酸构成的原电池中,正极产生1.12 L H2时,转移的电子数应为0.1NA | |
| C. | 一定条件下定容容器中充入3molH2(g)和1 mol N2(g)发生反应:H2(g)+N2(g)?2NH3 (g);△H=-QkJ/mol,当该反应放出0.25QkJ的热量时,容器中的氢分子数共有2.75 NA | |
| D. | 在50 g质量分数为46%的乙醇水溶液中,含有的氢原子总数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一个 | B. | 二个 | C. | 三个 | D. | 四个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com