
【题目】KClO3晶体是一种常见的氧化剂,生产工艺如图所示:
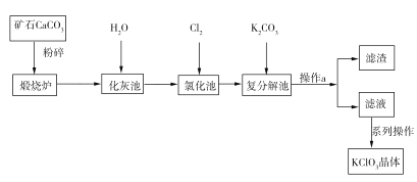
请回答下列问题:
(1)CaCO3煅烧前要粉碎的目的是____________________________。
(2)写出“氯化池”中生成Ca(ClO3)2的化学方程式:___________________________。该反应中,氧化剂与还原剂的物质的量之比为________。
(3)操作a中所需的玻璃仪器有漏斗、烧杯、__________。
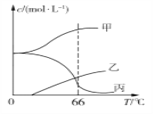
(4)实验室制取KClO3可通过反应:3Cl2+6KOH![]() 5KCl+KClO3+3H2O,在密闭容器中向9 ℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是________________;继续通入适量Cl2,将溶液加热,溶液中主要离子的浓度随温度的变化如图所示,图中甲、乙、丙依次表示的离子是_________。(不考虑Cl2的挥发)
5KCl+KClO3+3H2O,在密闭容器中向9 ℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是________________;继续通入适量Cl2,将溶液加热,溶液中主要离子的浓度随温度的变化如图所示,图中甲、乙、丙依次表示的离子是_________。(不考虑Cl2的挥发)
(5)甲同学为测定制取的KClO3样品中ClO3的含量,称取样品a g,准确配制成1000 mL溶液,从上述溶液中取出10.00 mL于锥形瓶中,准确加入30.00 mL 1.00 mol·L1 (NH4)2Fe(SO4)2溶液(过量)。再在锥形瓶中加入100 mL蒸馏水及某种氧化还原反应指示剂,用0.200 mol·L1 K2Cr2O7标准溶液滴定至终点,消耗5.00 mL。样品中ClO3的质量分数为______________。(已知:Cr2O72-+6Fe2++14H+![]() 2Cr3++6Fe3++7H2O,ClO3可被Fe2+还原为Cl。)
2Cr3++6Fe3++7H2O,ClO3可被Fe2+还原为Cl。)
【答案】 增大反应物接触面积,提高反应速率 6Ca(OH)2+6Cl2=5CaCl2+ Ca(ClO3)2+6H2O 5∶1 玻璃棒 KClO Cl、ClO3、ClO ![]()
【解析】(1)CaCO3煅烧前要粉碎的目的是增大反应物接触面积,提高反应速率。(2)碳酸钙高温分解生成氧化钙和二氧化碳,氧化钙与水反应生成氢氧化钙,因此“氯化池”中生成Ca(ClO3)2的化学方程式为6Ca(OH)2+6Cl2=5CaCl2+ Ca(ClO3)2+6H2O,其中氯化钙是还原产物,Ca(ClO3)2是氧化产物,所以该反应中氧化剂与还原剂的物质的量之比为5:1。(3)操作a是过滤,其中所需的玻璃仪器有漏斗、烧杯、玻璃棒。(4)低温下氯气和氢氧化钾反应生成氯化钾、次氯酸钾和水,则此时Cl2的氧化产物主要是KClO;氯气和氢氧化钾反应一定产生氯化钾,温度大于66℃时生成氯酸钾,所以根据图像可知甲是氯化钾,乙是氯酸钾,丙是次氯酸钾,即图中甲、乙、丙依次表示的离子分别是Cl、ClO3、ClO。(5)根据反应Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O可知剩余亚铁离子的物质的量是0.2mol/L×0.005L×6=0.006mol,则与氯酸根反应的亚铁离子为1mol/L×0.03L-0.006mol=0.024mol,ClO3可被Fe2+还原为Cl,根据电子得失守恒可知氯酸根的物质的量是0.024mol÷6=0.004mol,所以样品中ClO3的质量分数为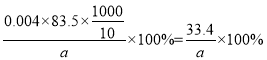 。
。


科目:高中化学 来源: 题型:
【题目】已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:
NaCN+HNO2===HCN+NaNO2
NaCN+HF===HCN+NaF
NaNO2+HF===HNO2+NaF
由此可判断下列叙述不正确的是 ( )
A. K(HF)=7.2×10-4 B. K(HNO2)=4.6×10-4
C. 根据其中任意两个反应即可得出结论 D. K(HCN)<K(HNO2)<K(HF)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 天然二氧化硅俗称硅石 B. 石英的主要成分是二氧化硅
C. 水晶是无色透明的石英晶体 D. 自然界中存在大量的单质硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将除去表面氧化膜的A1、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示。反应过程中有红棕色气体产生。下列说法错误的是 ( )

A. t1时刻前,A1片的电极反应为:2A1+3H2O - 6e- ═ A12O3+6H+
B. t1时,因A1在浓硝酸中钝化,氧化膜阻碍了A1继续反应
C. t1之后,负极Cu失电子,电流方向发生改变
D. 烧杯中发生的离子反应为:2NO2+2OH- ═ 2NO3-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C易溶于水,向其水溶液中滴入紫色石蕊试液,石蕊变红色,加热该溶液至沸腾,红色消失,因此,烹调富含维生素C的食物时,应该注意_________;在碱性条件下,维生素C易被空气氧化,烧煮时最好加一点_________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们穿的衣服通常是由纤维织成的,常见的纤维有棉花、羊毛、涤纶等。用灼烧法可初步鉴别三种纤维,给三种纤维编号后,分别灼烧产生的气味如下:
纤维编号 | ① | ② | ③ |
灼烧时的气味 | 特殊气味 | 烧纸气味 | 烧焦羽毛气味 |
则羊毛的编号为_________,棉花的编号为_________,涤纶的编号为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质A在一定条件下加热完全分解,产物都是气体。分解方程式为 4A=B+2C+2D,测得生成的混合气体对氢气的相对密度为2 d,则A的相对分子质量为( )
A. 7d B. 5d C. 2.5d D. 2d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法,错误的是
A.元素周期表是元素按原子序数大小排列而成的
B.元素原子的电子层数等于其所在周期的周期序数
C.元素原子的最外层电子数等于其所在族的族序数
D.元素周期表是元素周期律的具体表现形式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com