
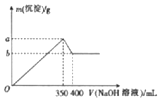
分析 (1)根据配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)根据n=cV和m=nM来计算;
(3)根据配制步骤来排序;
(4)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
解答 解:(1)操作步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器除托盘天平、烧杯、玻璃棒外,还必须用到的仪器有100ml容量瓶、胶头滴管等;
故答案为:100ml容量瓶;胶头滴管;
(2)由于无90mL容量瓶,故选用100mL的容量瓶,配制出的是100mL2.0mol•L-1NaOH溶液,所需NaOH的物质的量n=cV=2.0mol•L-1×0.1L=0.2mol,
质量m=nM=0.2mol×40g/mol=8g;
故答案为:8;
(3)配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶,所以操作步骤的正确顺序是①③⑤②④;
故答案为:①③⑤②④;
(4)①缺少步骤⑤,则溶质的物质的量偏小,所得溶液浓度偏低;
②若定容时仰视刻度线,则溶液的体积偏大,所得溶液浓度偏低
故答案为:偏低;小于;
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:实验题
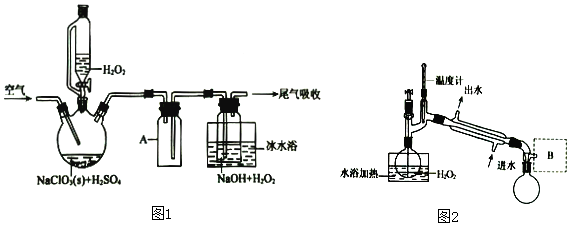
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1,3-丁二烯 | B. | 环丁二烯 | C. | 2-丁炔 | D. | 1-丁炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
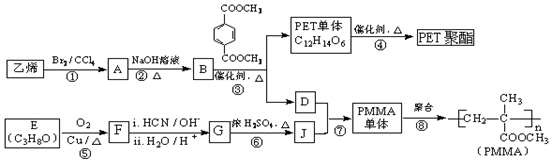
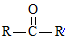 $→_{ii.H_{2}O/H+}^{i.HCN/OH-}$
$→_{ii.H_{2}O/H+}^{i.HCN/OH-}$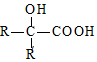 (R、R′代表烃基)
(R、R′代表烃基) .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | 只有① | C. | ②④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属及其化合物在化学中扮演着重要的角色,试根据各物质的性质完成下列问题:(1)钠与水反应时,钠漂浮在水面上.甲同学用刺有小孔的铝箱将0.46g钠包裹,而后投入水中,使钠沉入水底与水(足量)反应.反应结束后,生成的气体体积大于(填“大于”“小于”或“等于”) 224mL (标准状况).
金属及其化合物在化学中扮演着重要的角色,试根据各物质的性质完成下列问题:(1)钠与水反应时,钠漂浮在水面上.甲同学用刺有小孔的铝箱将0.46g钠包裹,而后投入水中,使钠沉入水底与水(足量)反应.反应结束后,生成的气体体积大于(填“大于”“小于”或“等于”) 224mL (标准状况). CuSO4+SO2↑+2H2O,生成SO2的物质的量小于0.46mol的原因是随着反应的进行硫酸的浓度逐渐减小,铜不与稀硫酸反应,所以产生SO2的物质的量小于0.46mol.
CuSO4+SO2↑+2H2O,生成SO2的物质的量小于0.46mol的原因是随着反应的进行硫酸的浓度逐渐减小,铜不与稀硫酸反应,所以产生SO2的物质的量小于0.46mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
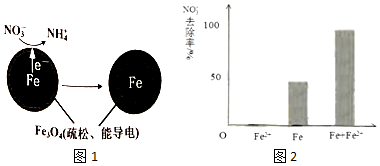
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 |  |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com