
【题目】海水提碘时,不小心将碘与食盐混合,欲将二者分离开,最好的方法是( )
A. 溶解、过滤B. 溶解、过滤、蒸发
C. 溶解、加硝酸银溶液、过滤D. 加热使碘升华
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中发生反应:N2O4(g)![]() 2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。

(1)该温度下,该反应的平衡常数为___________,若温度升高,K值将________(填“增大”、“减小”或“不变”)。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的是________点。从起点开始首次达到平衡时,以NO2表示的反应速率为________。
(3)25 min时,加入了________(填加入物质的化学式及加入的物质的量),使平衡发生了移动。
(4)d点对应NO2的物质的量浓度_______(填“大于”、“小于”或“等于”)0.8 mol·L-1,理由是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】麻黄素是中枢神经兴奋剂,其合成路线如下图所示。其中A为烃,相对分子质量为92,NHS是一种选择性溴代试剂。

已知:
(1)A的结构简式是______________,E中含氧官能团的名称为______________。
(2)反应B→C的反应条件和试剂是______________,D的结构简式为_______________。
(3)写出反应④的化学方程式_________________。
(4) F的同分异构体中能同时满足下列条件的共有_____种(不含立体异构):
①含有苯环 ②能与饱和NaHCO3溶液反应其中核磁共振氢谱为5组峰,且峰面积为3:2:2:2:1的物质的结构简式为____________(任写一种)。F的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是___________(填字母)。
a.质谱仪 b.红外光谱仪 c.核磁共振仪 d.元素分析仪
(5)请仿照题中流程图合成路线,设计以乙醛为起始主要原料合成强吸水性树脂的合成路线 ,___________其他试剂任选。
,___________其他试剂任选。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,最终一定有白色沉淀生成的是( )
①向AlCl3溶液中加入过量的氨水②向Na2SiO3溶液中通入过量的CO2;
③向Ca(OH)2溶液中通入过量CO2;④向CaCl2溶液中通入少量的CO2
A. ①② B. ①③④ C. ①④ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关蛋白质的说法中,不正确的
A. 鸡蛋清溶液中滴入浓硝酸微热有黄色沉淀生成
B. 采用多次盐析和溶解,可分离提纯蛋白质
C. 稀释后的福尔马林浸泡种子会使蛋白质变性
D. 蛋白质是仅由碳、氢、氧三种元素组成的高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100ml 1mol/L的AlCl3溶液与100ml 3.5mol/L的NaOH溶液混合,得到沉淀为( )
A. 7.8g B. 0g C. 9.1 g D. 3.9g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面配制500mL 0.1 mol/L的NaOH溶液的说法正确的是( )
A. 应先用称量纸在托盘天平上称取NaOH固体2g。
B. 定容时若仰视刻度线,会使所配NaOH溶液的浓度偏高。
C. 容量瓶应预先检漏并洗涤干净,但不需干燥,容量瓶中的少量水无影响。
D. 称好的NaOH固体应先放在烧杯中溶解,溶解完全后应立即转移至容量瓶中。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向20mL0.1mol/L的HR溶液中滴加0.1mol/LNaOH溶液,溶液的pH与滴加NaOH溶液体积V的关系如图所示。下列说法正确的是

A. HR为强电解质
B. 图中四点,水的电离程度:c>b>d>a
C. 若常温时0.1mol/LHR溶液的电离度为1%,则常温时R-的水解常数约为10-9
D. b点溶液中存在c(Na+)=c(R-)+c(HR)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组进行下面实验探究,查阅资料知道:
①2NO+Na2O2=2NaNO2
②2NO2+Na2O2=2NaNO3
③酸性KMnO4溶液可将NO2﹣氧化为NO3﹣,MnO4﹣被还原成Mn2+。
Ⅰ.产品制备与检验:用图20装置制备NaNO2
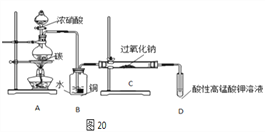
(1)写出装置A烧瓶中发生反应的化学方程式________________。
(2)B装置的作用是___________;盛浓硝酸的仪器名称为__________。
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为制备纯净的NaNO2,应在B、C装置间增加一个干燥管。在干燥管中盛放的试剂名称为____________。
(4)请设计实验,检验装置C中NaNO2的存在(写出操作、现象和结论)_________。
Ⅱ.含量的测定
称取装置C中反应后的固体4.00g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
(5)第一组实验数据出现异常,造成这种异常的原因可能是_________。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定结束后仰视读数
D.滴定结束后俯视读数
(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com