
【题目】反应A(g)十2B(g)===C(g)的反应过程中能最变化如下图所示。下列相关说法正确的是

A.曲线b表示使用催化剂后的能量变化
B.正反应活化能大于逆反应活化能
C.由图可知该反应的焓变△H=+91 kJmol-1
D.反应中将气体A换为固体反应,其他条件不变,反应放出热量大于91kJ
科目:高中化学 来源: 题型:
【题目】⑴化合物A和B的分子式都是C2H4Br2, A的核磁共振氢谱图如右图所示,则A的结构简式为:______________________,请预测B的核磁共振氢谱上有___________个峰(信号),强度之比为____________。

⑵根据下面的反应路线及所给信息填空

①.反应②的反应类型是_________________。
②.一氯环己烷的一硝基取代产物有________种(不考虑立体异构)。
③.反应④的化学方程式________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】electroFenton法是用于水体里有机污染物降解的高级氧化技术。其反应原理如图所示,其中电解产生的H2O2与Fe2+发生Fenton反应:Fe2++H2O2==Fe3++OH-+·OH,生成的羟基自由基(·OH)能氧化降解有机污染物。

下列说法不正确的是( )
A.电源的A极是负极
B.电解池中只有O2、Fe3+发生还原反应
C.阳极上发生电极反应:H2O -e- == ·OH + H+
D.消耗1molO2,可以产生4mol ·OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)浙江大学用甲醇、CO、O2在常压、某温度和催化剂的条件下合成碳酸二甲酯(DMC)的研究开发。
已知:ⅰ. CO的燃烧热:△H=-283.0 kJmol-1;
ⅱ.1mol H2O(l)完全蒸发变成H2O(g)需吸收44 kJ的热量;
ⅲ.2CH3OH(g)+CO2 (g) ![]() CH3OCOOCH3 (g)+H2O(g) △H=-15.5 kJmol-1
CH3OCOOCH3 (g)+H2O(g) △H=-15.5 kJmol-1
则2CH3OH(g)+CO (g)+ 1/2O2(g) ![]() CH3OCOOCH3 (g)+H2O(l) △H= 。该反应平衡常数K的表达式为: 。
CH3OCOOCH3 (g)+H2O(l) △H= 。该反应平衡常数K的表达式为: 。
(2)甲醇也是制备甲酸的一种重要原料。某温度时,将10mol甲酸钠溶于水,溶液显碱性,向该溶液中滴加1L某浓度的甲酸,使溶液呈中性,则滴加甲酸的过程中水的电离平衡将_____________(填“正向”、“逆向”或“不”) 移动, 此中性溶液中离子浓度由大到小的顺序为: 。
Ⅱ.甲醇和CO2可直接合成DMC:2CH3OH(g)+CO2 (g) ![]() CH3OCOOCH3 (g)+ H2O(g),但甲醇转化率通常不会超过1%,制约该反应走向工业化生产。
CH3OCOOCH3 (g)+ H2O(g),但甲醇转化率通常不会超过1%,制约该反应走向工业化生产。
(1)在恒容密闭容器中发生上述反应,能说明反应达到平衡状态的是 (选填编号)。
A.2v正(CH3OH)=v逆(CO2) B.CH3OH与H2O的物质的量之比保持不变
C.容器内气体的密度不变 D.容器内压强不变
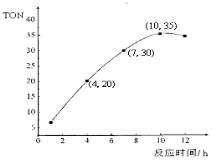
(2)某研究小组在某温度下,在100mL恒容密闭容器中投入2.5 mol CH3OH(g)、适量CO2和6×10-5 mol催化剂,研究反应时间对甲醇转化数(TON)的影响,其变化曲线如图所示。计算公式为:TON = 转化的甲醇的物质的量/催化剂的物质的量。在该温度下,最佳反应时间是 ;4~10 h内碳酸二甲酯的平均反应速率是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】有机物E是合成某药物的中间体,化合物E与氯化铁溶液发生显色反应,且环上的一元取代物只有两种结构;有机物N可转化为G、F,且生成的G、F物质的量之比为n(G)∶n(F)=1∶3,1 mol G与足量的金属钠反应产生H2 33.6L(标准状况)。各物质间的转化流程如下(无机产物省略):
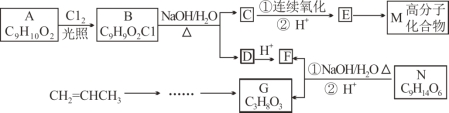
已知:①—ONa连在烃基上不会被氧化;
②同一个碳原子上连接2个-OH不稳定
请回答:
(1)E的结构简式 。
(2)下列说法不正确的是 。
A.化合物B、F都能发生取代反应
B.化合物A、G都能发生氧化反应
C.一定条件下,化合物F与G反应生成N,还可生成分子组成为C7H12O5和C5H10O4的化合物
D.从化合物A到M的转化过程中,涉及到的反应类型有取代反应、氧化反应、消去反应和缩聚反应
(3)写出B转化为C和D的化学方程式 。
(4)写出符合下列条件的化合物A的所有同分异构体的结构简式: 。
①含有苯环,且苯环上的一元取代物只有一种
②能与新制氢氧化铜悬浊液反应生成砖红色沉淀,且能与氯化铁溶液发生显色反应
(5)设计以CH2=CHCH3为原料制备G的合成路线(用流程图表示,无机试剂任选) 。(已知:![]() )
)
科网Z-X-X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验
Ⅰ.以H2O2的分解反应为研究对象,实验方案与数据记录如下表,t表示收集a mL O2所需的时间。
序号 | 反应 温度/℃ | c(H2O2)/ mol·L-1 | V(H2O2) /mL | m(MnO2) /g | t/min |
1 | 20 | 2 | 10 | 0 | t1 |
2 | 20 | 2 | 10 | 0.1 | t2 |
3 | 20 | 4 | 10 | 0.1 | t3 |
4 | 40 | 2 | 10 | 0.1 | t4 |
(1)设计实验2和实验3的目的是研究________________________对化学反应速率的影响。
(2)为研究温度对化学反应速率的影响,可以将实验________和实验________(填序号)作对比。
(3)将实验1和实验2作对比,t1________t2(填“>”、“<”或“=”)。
Ⅱ.以KI和FeCl3反应为例(2Fe3++2I-===2Fe2++I2)设计实验,探究此反应存在一定的限度。可选试剂:①0.1 mol·L-1 KI溶液 ②0.1 mol·L-1 FeCl3溶液
③0.1 mol·L-1 FeCl2溶液 ④0.1 mol·L-1 盐酸
⑤0.1 mol·L-1 KSCN溶液 ⑥CCl4
实验步骤:(1)取5 mL 0.1 mol·L-1 KI溶液,再滴加几滴0.1 mol·L-1 FeCl3溶液
(2)充分反应后,将溶液分成三份
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘
(4)另取一份,加试剂________(填序号),现象________________________,说明此反应存在一定的限度。
Ⅲ.N2O4可分解为NO2。在100 mL密闭容器中投入0.01 mol N2O4,利用现代化学实验技术跟踪测量c(NO2)。c(NO2)随时间变化的数据记录如下图所示。
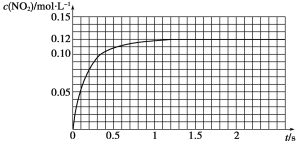
(1)反应容器中最后剩余的物质有________________,其中N2O4的物质的量为________mol。
(2)c(NO2)随时间变化的曲线表明,实验测得的化学反应速率在逐渐减小,从开始到平衡建立这段时间的平均反应速率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A~D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题
元素 | 性质或结构信息 |
A | 单质制成的高压灯,发出的黄光透雾力强、射程远。且其单质燃烧后生成淡黄色固体 |
B | 工业上通过分离液态空气获得其单质。原子的最外层电子数是内层电子总数的2.5倍 |
C | 单质是双原子分子,常温、常压下是淡黄绿色气体,原子的L层再增加一个电子即达到稳定结构 |
D | +2价阳离子的核外电子排布与氖原子相同 |
(1)上表中与A属于同一周期的元素是(写元素符号)_____ ,
画出D离子的结构示意图__________________ 。
(2)已知C的单质能与H2O发生置换反应生成O2,写出C单质与水反应的化学方程式_ 。
(3)对元素B的单质或化合物描述正确的是 _。
a.B元素的最高正价为+6 b.常温、常压下单质难溶于水
c.单质分子中含有18个电子 d.在一定条件下氢气能与单质B反应
(4)A和D两元素活泼性较强的是(写元素名称) _____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g)△H1=—99kJ.mol-1,
CH3OH(g)△H1=—99kJ.mol-1,
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H2=—58kJ.mol-1
CH3OH(g)+H2O(g)△H2=—58kJ.mol-1
③CO2(g)+H2(g)![]() CO(g)+H2O(g)△H3
CO(g)+H2O(g)△H3
回答下列问题:
(1)写出CO2的结构式__________。
(2)由上述数据计算出△H3=kJ.mol-1
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,温度T1、T2对反应的影响,下列正确的是__________(填序号)

①温度为T1时,从反应到平衡,生成甲醇的平均速率为:v(CH3OH)=nA/tAmol/(L·min)
②该反应在T1时的平衡常数比T2时的小
③当生成1mol甲醇的同时,生成1molCO2,说明反应达到平衡
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)与n(CH3OH)比值增大
(4)在T1温度时,将2molCO2和6molH2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为50%,,则容器内的压强与起始压强之比为__________;该温度条件下,反应平衡常数为__________(计算出结果)
(5)在直接以甲醇为燃料电池中,电解质溶液为硫酸性,负极的电极反应式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:
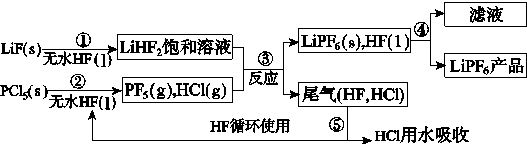
已知:HCl的沸点是-85.0 ℃,HF的沸点是19.5 ℃。
(1)第①步反应中无水HF的作用是________________、________________。反应设备不能用玻璃材质的原因是______________________________________________(用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的________溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:____________________________________。
(3)第④步分离采用的方法是________;第⑤步分离尾气中HF、HCl采用的方法是________。
(4)LiPF6产品中通常混有少量LiF。取样品w g,测得Li的物质的量为n mol,则该样品中LiPF6的物质的量为________mol(用含w、n的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com