


科目:高中化学 来源: 题型:
已知25℃时有关弱酸的电离平衡常数:
|
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省台州中学高二下学期期中考试化学试卷(带解析) 题型:填空题
(16分)镁化合物和氯气均具有广泛用途,请回答下列问题:
(1)写镁和氯气反应产物的电子式
(2)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。则下列选项中正确的是 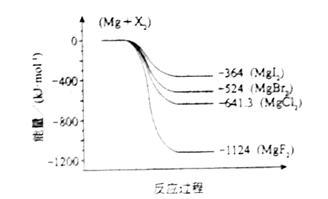
A MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力
B Mg与X2的反应是放热反应
C MgBr2与Cl2反应的△H<0
D 化合物的热稳定性顺序为MgI2>MgBr2>MgCl2>MgF2
(3)在298K、100Kpa时,在1L水中可溶解0.09mol氯气,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
①该反应的离子方程式为 ,平衡常数表达式为
②在上述平衡体系中加入少量NaCl固体,平衡将 (填“正向移动”、“逆向移动”、“不移动”);增大氯气的压强,氯气的溶解度将 ,氯气和水反应的平衡常数将
(填“变大”、“变小”、“不变”)。
③已知: H2CO3 HCO3- + H+ Ka1(H2CO3) = 4.45×10-7
HCO3- + H+ Ka1(H2CO3) = 4.45×10-7
HCO3- CO32- + H+ Ka2(H2CO3) = 5.61×10-11
CO32- + H+ Ka2(H2CO3) = 5.61×10-11
HClO  H+ + ClO- Ka(HClO) = 2.95×10-8
H+ + ClO- Ka(HClO) = 2.95×10-8
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
将少量的氯气通入到过量的碳酸钠溶液中____________________________________;
查看答案和解析>>
科目:高中化学 来源:2013届浙江省高二下学期期中考试化学试卷(解析版) 题型:填空题
(16分)镁化合物和氯气均具有广泛用途,请回答下列问题:
(1)写镁和氯气反应产物的电子式
(2)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。则下列选项中正确的是
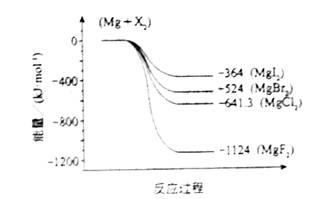
A MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力
B Mg与X2的反应是放热反应
C MgBr2与Cl2反应的△H<0
D 化合物的热稳定性顺序为MgI2>MgBr2>MgCl2>MgF2
(3)在298K、100Kpa时,在1L水中可溶解0.09mol氯气,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
① 该反应的离子方程式为 ,平衡常数表达式为
②在上述平衡体系中加入少量NaCl固体,平衡将 (填“正向移动”、“逆向移动”、“不移动”);增大氯气的压强,氯气的溶解度将 ,氯气和水反应的平衡常数将
(填“变大”、“变小”、“不变”)。
③已知:
H2CO3  HCO3- + H+
Ka1(H2CO3) = 4.45×10-7
HCO3- + H+
Ka1(H2CO3) = 4.45×10-7
HCO3- CO32- + H+
Ka2(H2CO3) = 5.61×10-11
CO32- + H+
Ka2(H2CO3) = 5.61×10-11
HClO  H+ + ClO-
Ka(HClO) = 2.95×10-8
H+ + ClO-
Ka(HClO) = 2.95×10-8
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
将少量的氯气通入到过量的碳酸钠溶液中____________________________________;
查看答案和解析>>
科目:高中化学 来源:0103 期中题 题型:填空题
 ④CH3COONH4 ⑤NH4HCO3
④CH3COONH4 ⑤NH4HCO3  > HCO3-
> HCO3- 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com