

分析 根据联合制碱法的原料为氨气、二氧化碳和饱和氯化钠,反应式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓;主要的副产物为氯化铵,需要考虑氯化铵的回收利用,要提高原料的利用率,可以用循环使用的方法,据此分析解题;
①工业制纯碱法为侯氏制碱或联合制碱法,主要副产品为NH4Cl;
②饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体;
③碳酸氢钠受热易分解生成CO2、水及纯碱;
④循环Ⅰ中的氯化钠有又返回到沉淀池
⑤根据氨气溶于水后生成氨水,氨水电离成铵根,增大铵根的浓度有利于氯化铵的析出来分析;同时通入氨气使溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度.
解答 解:①目前工业制碱方法有二:氨碱法和联合制碱法.题中方法由我们侯德邦所创,称为侯氏制碱法,也称为联合制碱法,反应方程式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,得到一摩尔的碳酸氢钠同时得到一摩尔的氯化铵,故副产物为氯化铵,氯化铵可用来制作化肥,故答案为:联合制碱法或侯德榜制碱法,做化肥;
②沉淀池中发生的化学反应为饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体,反应方程式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,
故答案为:NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓;
③在联合制碱法中二氧化碳是反应的原料同时也是反应的副产物,可以循环利用,故答案为:CO2;
④循环Ⅰ是将未反应的氯化钠返回沉淀池中,故答案为:循环Ⅰ;
⑤氨气溶于水后生成氨水,氨水电离成铵根,增大铵根的浓度有利于氯化铵的析出来,所以选项A正确;
通入氨气使溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度所以选项C正确,选项B错误;
故答案为:AC.
点评 本题主要考查了实验方案的设计,明确物质的性质是解本题关键,联合制碱法的原料、反应式以及副产物的回收利用,如何提高原料的利用率等,均属基础考查,难度中等.


科目:高中化学 来源: 题型:选择题
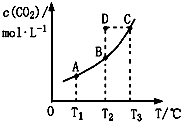
| A. | 该反应的△H<0 | |
| B. | 在T2时,D点的反应速率:ν(正)<(逆) | |
| C. | A、C两点相比,混合气体的平均相对分子质量:M(A)<M(C) | |
| D. | 若T1、T2时的平衡常数分别为K1、K2,则K1>K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在能使pH试纸变红的溶液中:Fe2+、Na+、Cl-、NO3- | |
| B. | 在含有S2-离子的溶液中:NH4+、K+、Cl-、SO42- | |
| C. | 在由水电离出的c(H+)=10-12mol•L-1的溶液中Na+、Ba2+、Cl- | |
| D. | 在无色溶液中:NH4+、Mg2+、SO42-、SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓 度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
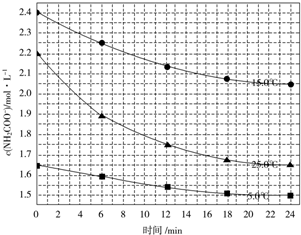
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
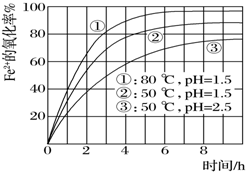 为了研究一定浓度Fe2+的溶液在不同条件下被氧气氧化的氧化率,实验结果如图所示,判断下列说法错误的是( )
为了研究一定浓度Fe2+的溶液在不同条件下被氧气氧化的氧化率,实验结果如图所示,判断下列说法错误的是( )| A. | pH越小氧化率越小 | |
| B. | 温度越高氧化率越大 | |
| C. | Fe2+的氧化率除受pH、温度影响外,还受其它因素影响,如浓度等 | |
| D. | 实验说明降低pH、升高温度有利于提高Fe2+的氧化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 不饱和酯类化合物在药物、涂料等方面应用广泛.
不饱和酯类化合物在药物、涂料等方面应用广泛. .
.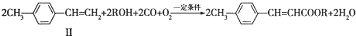
 (写1种);由Ⅳ生成Ⅱ的反应条件为氢氧化钠的醇溶液、加热.
(写1种);由Ⅳ生成Ⅱ的反应条件为氢氧化钠的醇溶液、加热.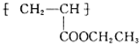 可用于制备涂料.其单体的结构简式为CH2=CHCOOCH2CH3.利用类似反应①的方法,仅以乙烯为有机原料合成该单体,涉及的反应方程式为CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,2CH2=CH2+2CH3CH2OH+2CO+O2$\stackrel{一定条件}{→}$2CH2=CHCOOCH2CH3+2H2O.
可用于制备涂料.其单体的结构简式为CH2=CHCOOCH2CH3.利用类似反应①的方法,仅以乙烯为有机原料合成该单体,涉及的反应方程式为CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,2CH2=CH2+2CH3CH2OH+2CO+O2$\stackrel{一定条件}{→}$2CH2=CHCOOCH2CH3+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com