
| A. | 该溶液物质的量浓度为10moL/L | |
| B. | 所得的溶液的体积为22.5L | |
| C. | 该溶液中溶质的质量分数因溶液的密度未知而无法求得 | |
| D. | 根据题干数据,该溶液物质的量浓度无法求得 |
分析 A.标准状况下22.4LHCl的物质的量为1mol,根据题目信息无法计算溶液的体积;
B.溶液体积不等于溶剂与溶质的体积之和,利用V=$\frac{m}{ρ}$计算溶液体积;
C.因溶液的密度未知,无法计算溶液的体积;
D.溶液质量=溶质质量+溶剂质量,溶质质量分数=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%,据此计算.
解答 解:A.标准状况下22.4LHCl的物质的量为:$\frac{22.4L}{22.4L/mol}$=1mol,溶于水配成100mL溶液,溶液的浓度为10mol/L,溶液体积必须为100mL,而不是溶剂的体积,因溶液的密度未知,无法计算溶液的体积,无计算该溶液的物质的量浓度,故A错误;
B.溶液体积不等于溶剂与溶质的体积之和,由于溶液的密度未知,无法计算溶液的体积,故B错误;
C.标准状况下22.4LHCl的物质的量为:$\frac{22.4L}{22.4L/mol}$=1mol,质量为:36.5g/mol×1mol=36.5g,4℃时100mL水的质量为100g,所以溶液溶质的质量分数为$\frac{36.5g}{36.5g+100g}$×100%=26.74%,故C错误;
D.因溶液的密度未知,无法计算溶液的体积,则无计算该溶液的物质的量浓度,故D正确;
故选D.
点评 本题考查了物质的量浓度的计算与判断,题目难度中等,注意掌握物质的量浓度理解及与质量分数的关系,试题侧重考查学生的分析、理解能力及化学计算能力.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 浓NaOH溶液 | B. | 饱和食盐水 | C. | 石灰乳 | D. | 浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
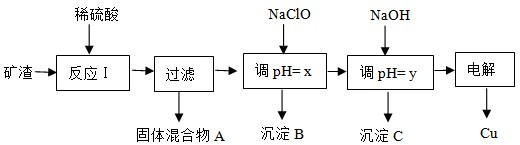
| 沉淀 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 2.2 | 5.8 |
| 沉淀完成pH | 6.7 | 5.2 | 3.2 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
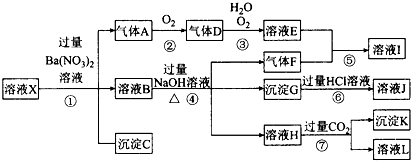
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
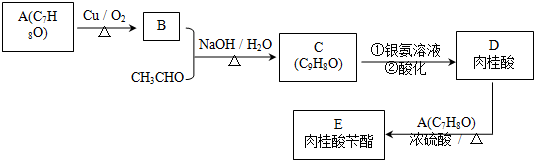

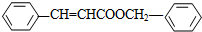 .
. .
. .
.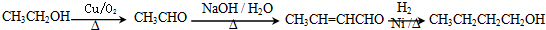 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 待提纯物质 | 杂质 | 除杂试剂及主要操作方法 |
| A | 乙烷 | 乙烯 | 酸性KMnO4溶液,洗气 |
| B | MgCl2溶液 | FeCl3 | MgO,过滤 |
| C | HCl气体 | Cl2 | 饱和食盐水,洗气 |
| D | 乙醇 | 水 | 生石灰,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成n mo1 O2的同时生成n mol NO2 | |
| B. | 单位时间内生成n mol O2的同时生成2n molNO | |
| C. | 混合气体的颜色不再改变 | |
| D. | 混合气体的平均密度不再改变的状态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com