
| A. | 将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 | |
| B. | 用托盘天平称量氢氧化钠时,直接放在托盘上称量 | |
| C. | 用稀硫酸洗涤并灼烧铂丝后,再进行焰色反应 | |
| D. | 取用化学药品时,应特别注意观察药品包装上的安全警示标志 |
分析 A、容量瓶不能用来直接盛装固体配制溶液;
B、氢氧化钠固体有腐蚀性,且易潮解;
C、铂丝用稀盐酸清洗;
D、取用化学药品时,应特别注意观察药品包装上的安全警示标记.
解答 解:A、容量瓶不能用来直接盛装固体配置溶液,要将固体先在烧杯中溶解,冷却至室温转移到容量瓶中,故A错误;
B、氢氧化钠固体有腐蚀性,且易潮解,故应放到烧杯里称量,故B错误;
C、铂丝用稀盐酸清洗,而不能用稀硫酸清洗,故C错误;
D、取用化学药品时,应特别注意观察药品包装上的安全警示标记,防止发生意外事故,故D正确;
故选D.
点评 本题考查实验安全及事故处理,难度不大,具备基本的化学实验技能是学习化学和进行化学探究活动的基础和保证,只有掌握化学实验的基本技能,才能安全、准确地进行化学实验.


科目:高中化学 来源: 题型:选择题
| A. | 溶液中c(H+)和c(OH-)都减小 | B. | 溶液中c(H+)增大 | ||
| C. | 醋酸电离平衡向左移动 | D. | 溶液的pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某温度下纯水的pH=6,该温度下10L pH=11的NaOH溶液中含OH-的数目为NA | |
| B. | 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子,则正极放出H2的体积为11.2L | |
| C. | 在反应Zn+2HNO3+NH4NO3═N2↑+3H2O+Zn(NO3)2中每溶解1mol Zn,转移的电子总数等于2NA | |
| D. | 5.4g Al分别与含溶质0.2mol的NaOH溶液、盐酸反应,生成H2分子数均为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲中由水电离出来的H+的物质的量浓度是乙$\frac{1}{10}$的倍 | |
| B. | 甲、乙两杯溶液物质的量浓度之间的关系为:c(甲)=10c(乙) | |
| C. | 中和含有等物质的量NaOH的溶液,需甲、乙两杯酸的体积(V)之间关系为:10V(甲)>V(乙) | |
| D. | 甲中的c(OH-)为乙中的c(OH-)的10倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
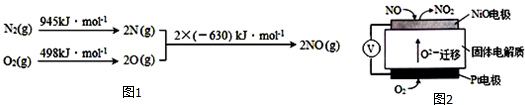
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸和碳酸钠溶液 | B. | 氯化铝溶液和氢氧化钠溶液 | ||
| C. | 稀盐酸和偏铝酸钠溶液 | D. | 碳酸钠溶液和氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
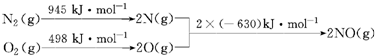
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用瓷坩埚熔融氢氧化钠或碳酸钠 | |
| B. | 用玻璃棒蘸取溶液,点在湿润的pH试纸上测定溶液的pH值 | |
| C. | 用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应 | |
| D. | 读取量筒内溶液液体的体积,俯视读数导致读数偏大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
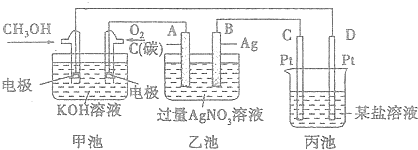
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com