
【题目】pc类似pH,是指稀溶液中离子的物质的量浓度的负对数。如溶液中某离子的物质的量浓度为![]() ,则该溶液中离子的pc=2。下列叙述正确的是( )
,则该溶液中离子的pc=2。下列叙述正确的是( )
A.用0.01mol·L-1的盐酸滴定某浓度的NaOH溶液,溶液的pH逐渐增大
B.向0.01mol·L-1的CaCl2溶液中逐滴加入纯碱溶液,滴加过程中pc(Ca2+)逐渐减小
C.0.01mol·L-1的Na2CO3溶液中,pc(Na+)=2pc(CO![]() )
)
D.常温下,纯水中pc(H+)+pc(OHˉ)=14
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】以NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.36g冰(图甲)中含共价键数目为4NA
B.12g金刚石(图乙)中含有σ键数目为4NA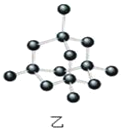
C.44g干冰(图丙)中含有NA个晶胞结构单元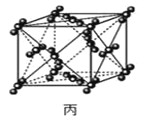
D.12g石墨(图丁)中含σ键数目3NA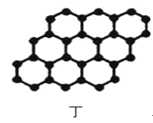
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.2mol·L-1H2X溶液中滴加0.2mol·L-1NaOH溶液,在不同pH环境下不同形态的粒子组成分数如图所示,下列说法正确的是
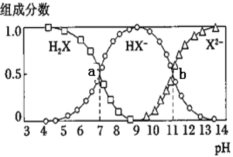
A.水的电离程度:b点小于点a
B.将等物质的量的NaHX、Na2X溶于水中,所得溶液pH恰好为11
C.常温下的Ka(HY)=1.1×10-10,将少量H2X溶液加入到足量NaY溶液中,发生的反应为:H2X+Y-=HY+HX-
D.常温下,反应X2-+H2OHX-+OH-的平衡常数对数值1gK=-11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,四边形![]() 内接于
内接于![]() ,
,![]() ,连接
,连接![]() 、
、![]() 交于点
交于点![]() .
.

(1)如图![]() ,求证:
,求证:![]() ;
;
(2)如图![]() ,过点
,过点![]() 作
作![]() 于点
于点![]() ,若
,若![]() ,求证:
,求证:![]() ;
;
(3)如图![]() ,在(2)的条件下,作
,在(2)的条件下,作![]() ,
,![]() 交
交![]() 于点
于点![]() ,
,![]() 交
交![]() 于点
于点![]() ,且
,且![]() ,若
,若![]() ,
,![]() ,求
,求![]() 的半径.
的半径.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二价铬不稳定, 极易被氧气氧化。醋酸亚铬水合物{ [Cr(CH3COO)2]2·2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水和醚,易溶于盐酸,是常用的氧气吸收剂。实验室中以锌粒、CrCl3溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如下图所示:
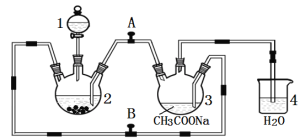
制备过程中发生的反应如下:
Zn(s) + 2HCl(aq) = ZnCl2(aq) + H2(g);
2CrCl3(aq) + Zn(s)= 2CrCl2 (aq) + ZnCl2(aq)
2Cr2+(aq) + 4CH3COO—(aq) + 2H2O(l) = [Cr(CH3COO)2]2·2H2O (s)
请回答下列问题:
(1)仪器1的名称是 , 所盛装的试剂是 。
(2)本实验中所用的溶液,配制用的蒸馏水都需事先煮沸,原因是 。
(3)实验开始生成H2气后, 为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应 阀门A、 阀门B (填“打开”或“关闭”)。
(4)本实验中锌粒须过量,其原因是 , 。
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质6.34 g,实验后得干燥纯净的[Cr(CH3COO)2]2·2H2O 5.64 g,请计算该实验所得产品的产率 。
(6)若使用该装置制备Fe(OH)2,且能较长时间看到Fe(OH)2白色沉淀现象。则在1、2、3中应装入的试剂依次为 、 、 。(写化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是大气污染物之一,也是重要的化工原料。
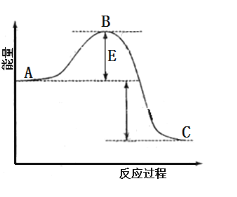
(1)某温度下,反应![]()
![]() 的能量变化如图。根据反应自发性判断,反应在______(填“高温”“低温”或“任何温度”)条件下可能有自发性,逆反应的活化能为______。
的能量变化如图。根据反应自发性判断,反应在______(填“高温”“低温”或“任何温度”)条件下可能有自发性,逆反应的活化能为______。
(2)将0.1 mol O2和0.2 mol SO2通入一容积可变的容器中进行反应:![]() 。测得SO2的平衡转化率随温度、压强的变化如图。
。测得SO2的平衡转化率随温度、压强的变化如图。
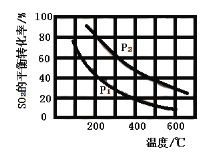
①![]() ______(填“>”“<”或“=”)
______(填“>”“<”或“=”)![]() 。
。
②若在300℃、压强为![]() 时,反应达到平衡,容器容积恰好为10 L,则此状态下反应的平衡常数K=____________。
时,反应达到平衡,容器容积恰好为10 L,则此状态下反应的平衡常数K=____________。
③反应![]() 在
在![]() 时刻达到平衡后,在
时刻达到平衡后,在![]() 时刻速率发生如图所示变化,此刻可能改变的反应条件可能是______(填标号)。
时刻速率发生如图所示变化,此刻可能改变的反应条件可能是______(填标号)。
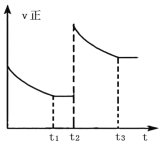
A.加压B.向体系中再通入一定量SO2
C.升高温度D.加催化剂
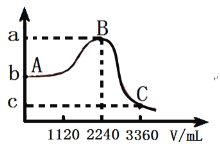
(3)常温下,向1L![]() 的水溶液中缓慢通入SO2气体(忽略溶液体积的变化),该溶液的pH与通入SO2气体的体积(标准状况)的关系如图,则
的水溶液中缓慢通入SO2气体(忽略溶液体积的变化),该溶液的pH与通入SO2气体的体积(标准状况)的关系如图,则![]() _____;
_____;![]() _____;
_____;![]() _____。已知:常温下,氢硫酸的
_____。已知:常温下,氢硫酸的![]() 、
、![]() ,亚硫酸的
,亚硫酸的![]() 、
、![]() ;
;![]() 。
。
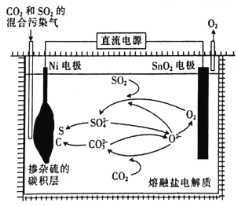
(4)用电解法处理CO2和SO2的混合污染气的原理如图所示,电解质为熔融碳酸盐和硫酸盐,通电一段时间后,Ni电极表面形成掺杂硫的碳积层,则与Ni电极相连的是电源的______(填“正极”或“负极”);阳极的电极反应式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对废银合金触电材料进行分离回收既节约矿物资源,又可以减少环境污染。某废银合金触电材料含Ag、Cu、Sn等,现欲利用以下工艺流程回收其中的金属资源。
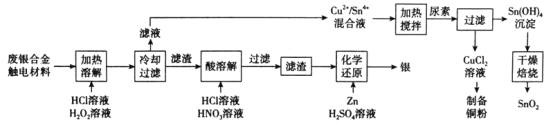
回答下列问题:
(1)“加热溶解”时Cu发生的离子方程式为_________。
(2)“加热溶解”时温度常控制在50℃左右,温度不宜过高也不宜过低的原因为_________。
(3)“酸溶解”过程中会产生少量遇空气变为红棕色的无色气体,则“酸溶解”过程主要的化学方程式为_____________。
(4)常温下,Cu2+/Sn4+混合液中c(Cu3+)=0.022mol·L-1,将混合液“加热搅拌”后冷却至室温,再加“尿素”调节溶液的pH范围为__________。(当溶液中的离子浓度小于10-5mol·L-1时,沉淀完全,已知:Ksp[Sn(OH)4]=1×10-55;Ksp[Cu(OH)2]=2.2×10-20)
(5)检验Sn(OH)4沉淀是否洗涤干净的方法是____________。
(6)用惰性电极电解CuCl2溶液,阴极反应式是___________,若想由CuCl2溶液得到无水CuCl2固体,则需进行的实验操作为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】螺环烃是指分子中两个碳环共用一个碳原子的脂环烃。螺环烃A(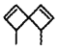 )是其中的一种。下列关于螺环烃A的说法中正确的是( )
)是其中的一种。下列关于螺环烃A的说法中正确的是( )
A.所有碳原子可能共平面
B.属于芳香烃的同分异构体数目有5种
C.常温时密度比水小,能溶于水及甲苯
D.与HBr以物质的量之比1:1加成生成的产物有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 某有机物
某有机物![]() 和
和![]() 氧气在一密闭容器中充分燃烧,所得产物通过浓硫酸时使其增重
氧气在一密闭容器中充分燃烧,所得产物通过浓硫酸时使其增重![]() ,再通过足量灼热的氧化铜粉末,固体质量减少
,再通过足量灼热的氧化铜粉末,固体质量减少![]() ,最后再通过足量过氧化钠粉末,固体质量增加了
,最后再通过足量过氧化钠粉末,固体质量增加了![]() 。请回答:
。请回答:
(1)该化合物![]() 的分子式为_______。
的分子式为_______。
(2)简要写出推理过程_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com