
| A. | 铝需经过特别处理能具有抗腐蚀能力 | |
| B. | “地沟油”经过加工处理可用来制肥皂 | |
| C. | 嫦娥系列卫星中使用的碳纤维,是一种新型无机非金属材料 | |
| D. | 只要符合限量,“食用色素”、“亚硝酸盐”可以作为某些食品的添加剂 |
分析 A.常温下,铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而防止铝进一步氧化;
B.“地沟油”的主要成分是高级脂肪酸甘油酯,油酯在碱性条件下发生皂化反应,生成肥皂;
C.无机非金属材是以某些元素的氧化物、碳化物、氮化物、卤素化合物、硼化物以及硅酸盐、铝酸盐、磷酸盐、硼酸盐等物质组成的材料,是除有机高分子材料和金属材料以外的所有材料的统称;
D.正确使用食品添加剂对人体健康有益.
解答 解:A.常温下,铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,具有抗腐蚀能力,从而防止铝进一步氧化,故A错误;
B.“地沟油”的主要成分是高级脂肪酸甘油酯,高级脂肪酸甘油酯在碱性条件下发生皂化反应,生成肥皂,故B正确;
C.碳纤维是一种新型无机非金属材料,故C正确;
D.任何食品添加剂必须控制用量,特别是有害于身体健康的添加剂,在限量范围之内使用不会引起中毒,故D正确;
故选A.
点评 本题考查化学与科学、技术、社会、环境等问题,题目难度不大,侧重对基础知识的巩固,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 30.8% | B. | 28.6% | C. | 25.3% | D. | 22.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 2mol•L-1 KCl溶液 | B. | 75mL 0.5mol•L-1CaCl2溶液 | ||
| C. | 150mL 1mol•L-1 NaCl溶液 | D. | 75mL 1mol•L-1AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16gO2中含有的氧分子数为NA | |
| B. | 1molOH-中含有的电子数为10NA | |
| C. | 标准状况下,11.2LH2O中含有的氢原子数为NA | |
| D. | 1mol/LBaCl2溶液中含有的钡离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
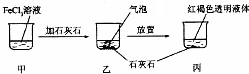
| A. | 反应过程中产生的气体是CO2 | |
| B. | 丙中液体可产生“丁达尔效应” | |
| C. | 若忽略溶液体积的变化,烧杯中c(Cl- )不发生变化 | |
| D. | 若在丙中加入过量盐酸,充分反应后所得溶液组成与甲相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①②③ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com