
分析 ①酸性溶液的pH不能等于或大于7;
②设溶液体积为1L,计算出硫酸中氢离子、氢氧化钠溶液中氢氧根离子的物质的量,然后判断过量,计算出混合液中氢离子浓度,最后根据pH=-c(H+)计算出溶液的pH;
③设溶液体积为1L,计算出硫酸中氢离子、氢氧化钠溶液中氢氧根离子的物质的量,然后判断过量,计算出混合液中氢离子浓度,最后根据pH=-c(H+)计算出溶液的pH.
解答 解:①1mL pH=2的硫酸加水稀释至105mL,溶液仍显酸性,所以pH接近7;
故答案为:接近7;
②设两溶液的体积为1L,1L 0.015mol/L的硫酸中氢离子的物质的量为:n(H+)=0.015mol/L×2×1L=0.03mol,
1L 0.01mol/L的NaOH溶液中含有氢氧根离子的物质的量为:n(OH-)=0.01mol/L×1L=0.01mol,
硫酸过量,混合液中氢离子浓度为:c(H+)=$\frac{0.03mol-0.01mol}{2L}$=0.01mol/L,
混合液的pH=-lg0.01=2;
故答案为:2;
③设两溶液的体积为1L,1L pH=4的硫酸中氢离子的物质的量为:n(H+)=10-4mol,
1L pH=12的NaOH溶液中含有氢氧根离子的物质的量为:n(OH-)=10-2mol,
NaOH过量,混合液中氢氧根离子浓度为:c(OH-)=$\frac{1{0}^{-2}mol-1{0}^{-4}mol}{2L}$,则c(H+)=$\frac{1{0}^{-14}}{\frac{1{0}^{-2}-1{0}^{-4}}{2}}$≈2×10-12mol/L,pH=12-0.3=11.7
故答案为:11.7.
点评 本题考查了溶液pH的计算,题目难度中等,注意掌握溶液酸碱性与溶液pH的计算方法,明确酸与酸、碱与碱、酸与碱的混合液的pH的计算方法,试题培养了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
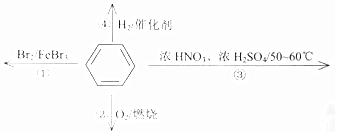
| A. | 反应①为取代反应,有机产物与水混合浮在上层 | |
| B. | 反应②为氧化反应,反应现象是火焰明亮并有大量黑烟 | |
| C. | 反应③为取代反应,控制反应温度在50~60℃的方法是用酒精灯直接加热 | |
| D. | 反应④中1mol苯最多与3molH2发生加成反应,原因是苯分子含有三个碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温时硅化学性质不活泼,不能与任何物质反应 | |
| B. | 晶体硅具有金属光泽,可以导电,属于金属材料 | |
| C. | Na2SiO3是制备硅胶和木材防火剂的原料 | |
| D. | 二氧化硅是将太阳能转化为电能的常用材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测定时间 (h) | 0 | 1 | 2 | 4 | 8 |
| 雨水的pH值 | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
; ;
; 所含官能团的名称是碳碳双键,醛基;该有机物发生加聚反应后,所得产物的结构简式为
所含官能团的名称是碳碳双键,醛基;该有机物发生加聚反应后,所得产物的结构简式为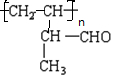 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:8 | B. | 8:1 | C. | 1:5 | D. | 5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砹是一种有色固体,它的气态氢化物很不稳定 | |
| B. | 溴化氢比氯化氢稳定,HClO4酸性强于HBrO4 | |
| C. | 铷的硫酸盐易溶解于水,其氢氧化物一定是强碱 | |
| D. | F2与水反应比Cl2与水反应剧烈 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com