
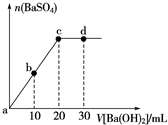
| A. | 溶液的pH:a<b<c<d | B. | 溶液的导电性:c<d | ||
| C. | a、b溶液呈酸性 | D. | c、d溶液呈碱性 |
分析 硫酸和氢氧化钡反应方程式为Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O,根据方程式知,随着反应的进行,溶液中离子浓度逐渐减小直至其完全反应,c点恰好反应,之后相当于氢氧化钡溶液被稀释.
A.硫酸溶液呈酸性,随着氢氧化钡的加入,溶液中氢离子浓度逐渐减小,pH逐渐增大;
B.溶液导电能力与离子浓度成正比;
C.a、b点碱不足量,硫酸有剩余;
D.c点酸碱恰好反应生成硫酸钡和水,d点氢氧化钡过量.
解答 解:A.从a到c酸不断消耗,酸性不断减弱PH不断变大,直到硫酸恰好反应,c点PH=7,再到d点溶液显碱性PH大于7,故A正确;
B.从a到c的过程中随着反应的进行溶液中离子浓度不断变小导电性也不断变弱,到c点两物质恰好反应,继续加入氢氧化钡溶液的导电性又会不断增强,故B正确;
C.a、b点碱不足量,硫酸没有完全中和掉,所以溶液呈酸性,故C正确;
D.c点酸碱恰好反应生成硫酸钡和水,d点氢氧化钡过量,所以c溶液呈中性、d溶液呈碱性,故D错误,
故选D.
点评 本题考查溶液pH、溶液导电性判断等知识点,关键明确发生的反应判断各点过量问题,注意溶液导电能力与离子浓度成正比,与电解质强弱无关.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:解答题
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 多吃肉,少吃蔬菜水果 | |
| B. | 合理摄入糖类、油脂等,注意膳食平衡 | |
| C. | 为防止变胖,炒菜时不放油 | |
| D. | 多饮用纯净水,少饮用矿泉水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性氧化物 氧化铁 FeO | B. | 酸性氧化物 碳酸气 CO2 | ||
| C. | 酸 硫酸 H2S | D. | 盐 纯碱 NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验剩余的药品不能放回原试剂瓶 | |
| B. | 可燃性气体的验纯 | |
| C. | 气体实验装置在实验前进行气密性检查 | |
| D. | 分液时,上层的液体由上端瓶口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它是高分子化合物 | |
| B. | 它在一定条件下能水解,最终生成葡萄糖 | |
| C. | 是天然蛋白质,仅由C、H、O、N四种元素组成 | |
| D. | 是一种特殊的蛋白质,滴加浓HNO3不发生颜色反应,灼烧时没有任何气味 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com