
| 50ml盐酸 | 50ml盐酸 | 50ml盐酸 | |
| m(混合物) | 9.2g | 13.8g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
| A. | 13.8g混合物恰好能与50ml盐酸完全反应 | |
| B. | 根据表中数据不能计算出混合物中NaHCO3的质量分数 | |
| C. | 向50ml盐酸中加入混合物27.6g时,盐酸过量 | |
| D. | 盐酸的物质的量浓度为5.0mol/L |
分析 由题意可知:9.2 g混合物与50 mL盐酸反应时盐酸过量,而27.6 g混合物与50 mL盐酸作用时盐酸不足;
由反应H++HCO3-=CO2↑+H2O知,盐酸的物质的量为:n(HCl)=n(CO2)=$\frac{2.24L}{22.4L/mol}$=0.15 mol,根据c=$\frac{n}{V}$可计算出盐酸的浓度;
设9.2 g混合物中NaHCO3、KHCO3的物质的量分别为x和y,
则有:x+y=0.1mol ①
84x+100y=9.2g ②
解得:x=0.05 mol,y=0.05 mol
w(NaHCO3)=$\frac{84}{84+100}$×100%=45.65%
又由n(NaHCO3)=n(KHCO3),84•n(NaHCO3)+100•n(KHCO3)=13.8,
解得:n (NaHCO3)=0.075 mol,所以13.8g混合物完全反应消耗HCl的物质的量为:0.075 mol×2=0.15mol,故恰好完全反应,据此进行判断.
解答 解:由题意可知:9.2 g混合物与50 mL盐酸反应时盐酸过量,而27.6 g混合物与50 mL盐酸作用时盐酸不足;
由反应H++HCO3-=CO2↑+H2O知,盐酸的物质的量为:n(HCl)=n(CO2)=$\frac{2.24L}{22.4L/mol}$=0.1 mol,
设9.2 g混合物中NaHCO3、KHCO3的物质的量分别为x和y,
则有:x+y=0.1mol ①
84x+100y=9.2g ②
解得:x=0.05 mol,y=0.05 mol
所以c(HCl)=0.15 mol/0.05 L=3 mol/L;
w(NaHCO3)=$\frac{84}{84+100}$×100%=45.65%
又由n(NaHCO3)=n(KHCO3),84•n(NaHCO3)+100•n(KHCO3)=13.8,
解得:n (NaHCO3)=0.075 mol,所以13.8g混合物完全反应消耗HCl的物质的量为:0.075 mol×2=0.15mol,故恰好完全反应,
A.根据分析可知,13.8g混合物恰好能与50mL盐酸完全反应,故A正确;
B.根据表中数据能够计算出碳酸氢钠的质量分数,故B错误;
C.向50mL盐酸中加入混合物13.8g时恰好反应,则加入27.6g混合物时,混合物过量,盐酸不足,故C错误;
D.该盐酸的物质的量浓度为:n(HCl)=$\frac{0.15mol}{0.05L}$=3mol/L,故D错误;
故选A.
点评 本题考查混合物反应的计算,侧重于学生数据分析能力和计算能力的考查,题目难度中等,本题注意比较三组数据,判断反应的程度,为解答该题的关键点,也是易错点.


科目:高中化学 来源: 题型:多选题
| A. | 正极为Cu、负极为Fe,电解质溶液为FeCl3溶液 | |
| B. | 正极为C、负极为Fe,电解质溶液为H2SO4溶液 | |
| C. | 正极为Ag、负极为Fe,电解质溶液为FeSO4溶液 | |
| D. | 正极为Ag、负极为Fe,电解质溶液为Fe2(SO4)3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与硫酸铜溶液反应:Fe+Cu2+=Fe2++Cu | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 碳酸钙与盐酸反应:CO${\;}_{3}^{2-}$+2H+=CO2↑+H2O | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO${\;}_{4}^{2-}$=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是七个基本物理量之一 | B. | 阿伏伽德罗常数是没有单位的 | ||
| C. | 氮气的摩尔质量是28g | D. | 1molH2O约含有6.02×1023个水分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
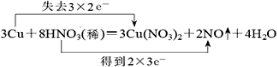 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和硫的熔化 | B. | 食盐和石蜡的熔化 | ||
| C. | 碘和干冰的升华 | D. | 二氧化硅和氧化钠的熔化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰融化时,分子中氢氧键发生断裂 | |
| B. | 原子晶体中共价键越强,熔点和沸点越高 | |
| C. | 分子晶体中共价键键能越大,该分子晶体的熔点和沸点一定也越高 | |
| D. | 分子晶体中分子间作用力越大,该物质越稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com