
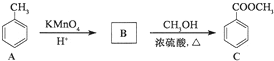
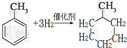
 ,反应类型为加成反应.
,反应类型为加成反应.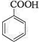 ,所得B的粗产品通常用重结晶的方法提纯.
,所得B的粗产品通常用重结晶的方法提纯.分析 (1)甲苯中的苯环与氢气能发生加成反应,生成甲基环已烷;
(2)比较A和C的结构简式可知,A发生氧化反应生成B为 ,根据苯甲酸在水中的溶解度与温度的关系可知苯甲酸的提纯方法;
,根据苯甲酸在水中的溶解度与温度的关系可知苯甲酸的提纯方法;
(3)苯甲酸与甲醇在浓硫酸作催化剂和吸水剂的条件下加热发生酯化反应生成C;
解答 解:(1)甲苯中的苯环与氢气能发生加成反应,生成甲基环已烷,反应的化学方程式为 ,
,
故答案为: ;加成反应;
;加成反应;
(2)比较A和C的结构简式可知,A发生氧化反应生成B为 ,根据苯甲酸在水中的溶解度与温度的关系可知苯甲酸的提纯方法是重结晶,
,根据苯甲酸在水中的溶解度与温度的关系可知苯甲酸的提纯方法是重结晶,
故答案为: ;重结晶;
;重结晶;
(3)苯甲酸与甲醇在浓硫酸作催化剂和吸水剂的条件下加热发生酯化反应生成C,
故答案为:催化剂和吸水剂.
点评 本题考查以有机物合成考查有机物结构与性质,为高频考点,涉及苯的同系物、羧酸性质的考查,把握官能团与性质的关系即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 元素X的简单气态氢化物的热稳定性性比W的弱 | |
| B. | 元素W的最高价氧化物对应水化物的酸性比Z的弱 | |
| C. | 原子半径的大小顺序:rY>rz>rw>rx | |
| D. | 元素Y、Z的氧化物中化学键的类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成SO3 2mol | |
| B. | SO2和SO3物质的量之和一定为2mol | |
| C. | 反应放出197kJ的热量 | |
| D. | SO2的物质的量和SO3物质的量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W、Q是原子序数依次增大的前四周期元素.已知X、Y、Z、W均为非金属元素,X的基态原子由2个未成对电子,XW2分子与Y3为等电子体,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和,根据以上信息回答下列问题:
X、Y、Z、W、Q是原子序数依次增大的前四周期元素.已知X、Y、Z、W均为非金属元素,X的基态原子由2个未成对电子,XW2分子与Y3为等电子体,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和,根据以上信息回答下列问题: ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电负性 | 键长 | 键的极性 | 沸点(同压) |
| C<N | C=C<C-C | N-H<O-H | 甲醇>丁烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com