
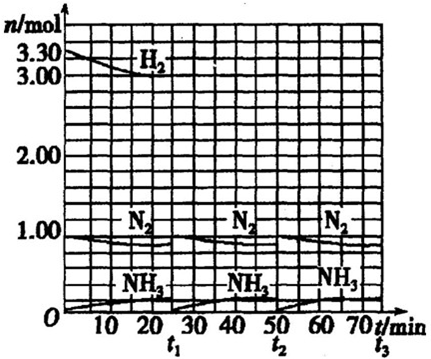
| ||
| △t |
| 参加反应氢气的物质的量 |
| 氢气总的物质的量 |
| ||
| 15min |
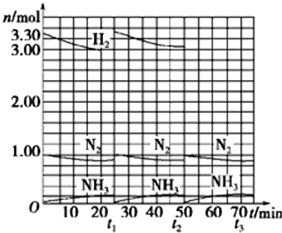 ,
, ;
;| 0.3mol |
| 3.3mol |
| 0.3mol |
| 3.33mol |


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH | 浓硫酸 | △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
| KOH g/100g水 | 49.2 | 50.8 | 52.8 | 59.8 | 62.4 | 78.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
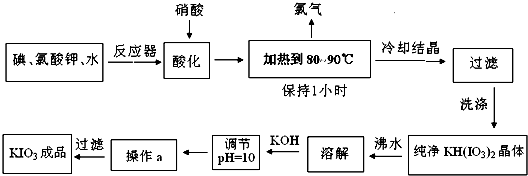
碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,试回答下列问题:
⑴配平反应器中发生的反应方程式:
I2 + KIO3 + H2O== KH(IO3)2 + KCl + Cl2↑
⑵步骤②中,用硝酸而不用HI,其原因可能是
⑶步骤③要保持溶液微沸1小时,以完全排出氯气,排出氯气的原因为
⑷合成实验中涉及两次过滤,在实验室进行过滤实验时,用到的玻璃仪器有
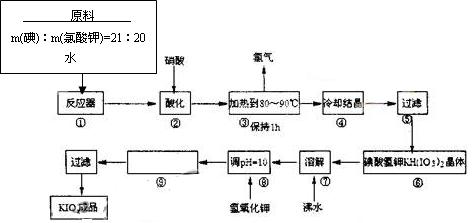
⑸用氢氧化钾调节溶液的PH值,发生的反应方程式为:
⑹参照碘酸钾溶解度曲线,步骤得到碘酸钾晶体,你建议的方法是
| 温度 | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
《化学与生活》
(1)现有下列几种物质 A.食盐 B.食醋 C.苹果汁 D.葡萄糖 E.青霉素F.阿司匹林。请按下列要求填空(填序号)。
富含维生素C的是 ;应用最广泛的抗生素之一的是 ;可直接进入血液补充能量的是 ;食用过多会引起血压升高、肾脏受损的是 。
(2)人体摄入的蛋白质,在酶的催化作用下发生水解,最终生成氨基酸。这些氨基酸一部分重新合成人体所需的蛋白质、糖或脂类物质,以满足各种生命活动的需要;另一部分则发生氧化反应,释放能量。
①蛋白质分子中主要含有 四种元素。
②蛋白质溶液遇到浓的硫酸铵等无机盐溶液,会析出沉淀;再加适量水后,蛋白质重新溶解,仍然具有原来的活性。这个过程称为 。
③人体中共有二十多种氨基酸,其中有几种是人体自身不能合成的,必须由食物获得,称为 氨基酸。
(3)防止水体污染,改善水质,最根本的措施是控制工业废水和生活污水的排放。有一种工业废水,已知其中含有大量的Fe2+ 和SO42-,少量的Ag+和Na+,以及部分污泥。某校化学兴趣小组同学通过下列操作过程,回收物质,处理废水。


根据上述操作过程,回答下列问题:
|
|
b.操作②的名称是 。
c.向溶液A中需要加入过量X,X是 ,发生反应的离子方程式为 。
d.上述操作回收到的物质是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com