
(本题共12分)乙酸正丁酯常用作香精,实验室用冰醋酸和正丁醇制备乙酸正丁酯
Ⅰ.乙酸正丁酯粗产品的制备
试管中加少许入沸石、7.4 mL正丁醇和6.4 mL冰醋酸,再加入3~4滴浓硫酸,然后安装好装置,加热使之反应。
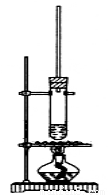
Ⅱ.乙酸正丁酯粗产品的精制
将试管中的液体转移到分液漏斗中,用10 mL水洗涤,除去下层水层;有机层继续用10 mL 10% Na2CO3洗涤至中性;再用10 mL 的水洗涤。
将酯层进行蒸馏。蒸馏收集乙酸正丁酯产品时,应将温度控制在126.1℃左右。
Ⅲ.计算产率
称量出制得的乙酸正丁酯的质量为5. 12 g。
已知:
物质 | 密度/g·cm-3 | 沸点/℃ | 溶解度/100g水 |
正丁醇 | 0.810 | 118.0 | 9 |
冰醋酸 | 1.049 | 118.1 | 互溶 |
乙酸正丁酯 | 0.882 | 126.1 | 0.7 |
完成下列填空:

(1)上图装置中长导管有冷凝回流作用,它可以由分水回流装置代替。分水回流装置中回流下来的蒸气冷凝液进入分水器,待分层后,有机层会自动流回到反应器中,将生成的水从分水器中放出去。
分水回流代替长导管回流,对乙酸正丁酯的合成有什么作用 。
使用分水器装置进行回流的可逆反应,一般应具备 条件。
(2)分水器在使用时须预先加水,使其水面低于分水器回流支管下沿3~5 mm的水。
预先加水的目的是 。
(3)反应时加热有利于 提高酯的产率,但温度过高时酯的产率反而降低,
其可能的原因是 。
(4)水洗的目的是 。碱洗的目的是 。
测pH值的操作 。
(5)本次实验乙酸正丁酯的产率 。
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源:2014-2015黑龙江省鸡西市龙东南四校高二上学期期末联考化学试卷(解析版) 题型:选择题
下列各物质投入水中,因促进水的电离而使溶液呈碱性的是
A.NaOH B.NH3 C.CH3COONa D.NH4Cl
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省高二上学期期末考试化学试卷(解析版) 题型:填空题
(8分)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的1/4。
(1)为了降低某水库的铁闸门被腐蚀的速率,可以采用下图所示甲的方案,属于 原理(填“原电池”或“电解池”)
(2)下图中乙方案也可降低铁闸门腐蚀速率,称为 保护法。
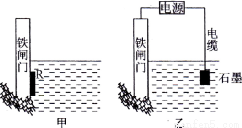
(3)将5 mol/L CuSO4溶液200mL用惰性电极电解一段时间后,从其中的一个电极收集到标准状况下448 mL气体,为使电解后的溶液恢复到开始的浓度,应向电解后的溶液中加入 g 物质(填化学式)。
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省高二上学期期末考试化学试卷(解析版) 题型:选择题
将2molSO2和2molSO3气体,混合于一固定体积的密闭容器中,在一定条件下发生反应:2SO2+O2 2SO3平衡时SO3为W mol;在相同温度下,分别按下列配比在相同体积的密闭容器中加入起始物质,平衡时SO3的物质的量大于W mol的是
2SO3平衡时SO3为W mol;在相同温度下,分别按下列配比在相同体积的密闭容器中加入起始物质,平衡时SO3的物质的量大于W mol的是
A.2molSO2 、1molO2 B.4molSO2 、1molO2
C.2molSO2 、1molO2 、2mol SO3 D.1molSO2 、2mol SO3
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省高二上学期期末考试化学试卷(解析版) 题型:选择题
下列仪器“0”刻度位置正确的是
A.在量筒的上端 B.在滴定管上端
C.在托盘天平分度盘的正中 D.在容量瓶的上端
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市十三校高三第二次联考化学试卷(解析版) 题型:选择题
将0.5 mol·L-1的Na2CO3溶液与amol·L-1的NaHCO3溶液等体积混合,所得溶液中粒子浓度间的关系及相关判断正确的是
A.c(Na+)>2c(CO32-)+c(HCO3-)+c(OH-)
B.c(Na+)>c(CO32-)+c(HCO3-)+c(H2CO3)
C.若c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),则可确定a>0.5
D.若c(CO32-)+2c(OH-) = 2c(H+)+c(HCO3-)+3c (H2CO3), 则可确定a=0.5
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市十三校高三第二次联考化学试卷(解析版) 题型:选择题
物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂。下列关于物质X的说法正确的是
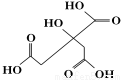
A.X分子式为C6H6O7
B.1 mol物质X可以和3 mol氢气发生加成
C.X分子不可以发生消除反应
D.足量的X分别与等物质的量的NaHCO3、Na2CO3反应得到的气体物质的量相同
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市顺义区高三第一次统一练习化学试卷(解析版) 题型:填空题
(8分)铁是当代社会中用量最大的金属之一。磁铁矿是工业上冶炼铁的原料之一,发生的主要反应为:Fe3O4(s)+4CO 3Fe(s)+4CO2
3Fe(s)+4CO2
(1)已知:①Fe3O4(s)+4C(石墨) 3Fe(s)+4CO(g) ΔH=+646.0 kJ/mol
3Fe(s)+4CO(g) ΔH=+646.0 kJ/mol
②C(石墨)+CO2(g) 2CO(g) ΔH=+172.5 kJ/mol
2CO(g) ΔH=+172.5 kJ/mol
由Fe3O4(s)与CO反应生成Fe(s)的热化学方程式是 。
(2)T℃时,在 2L恒容密闭容器中,加入Fe3O4、CO各1.0 mol ,10 min反应达到平衡时,容器中CO2的浓度是0.4 mol /L。
①能证明该反应达到化学平衡的是 (选填字母)。
a.容器内压强不再变化
b.容器内CO、CO2物质的量比为1 : 1
c.容器内气体的质量不再变化
d.生成CO2的速率与消耗CO的速率相等
②CO的平衡转化率是 。
③l0 min内,反应的平均反应速率v (CO2)= 。
④欲提高该反应中CO的平衡转化率,可采取的措施是 (选填字母)。
a.提高反应温度 b.移出部分CO2
c.加入合适的催化剂 d.减小容器的容积
⑤T℃时,该反应的平衡常数K= 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市通州区高三模拟考试(一)理综化学试卷(解析版) 题型:选择题
常温下,1L pH=3的H2SO4溶液与下列溶液混合,其说法正确的是
A.与等体积pH=11的氨水混合后所得溶液pH小于7
B.与pH=3的CH3COOH溶液混合后所得溶液pH小于3
C.与等浓度的CH3COONa溶液混合后所得溶液pH一定小于7
D.与10L Ba(OH)2溶液恰好完全反应,则Ba(OH)2溶液的pH一定等于10
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com