
【题目】A为日常生活中常见的化合物,B为淡黄色固体,C、G、H均为气体,其中C、H为单质,G能使红色石蕊试剂变蓝,E是一种由两种元素组成的具有耐高温、硬度大的耐热冲击材料,其摩尔质量为 41 g/moL。

⑴B的电子式为_____。
⑵E的化学式为_____。
⑶写出反应②的离子方程式(D足量):_____。
⑷写出反应③的化学方程式:_____。
【答案】![]() AlN AlN+OH- +H2O=AlO2-+NH3 ↑ 4NH3+3O2
AlN AlN+OH- +H2O=AlO2-+NH3 ↑ 4NH3+3O2 ![]() 2N2↑ +6H2O
2N2↑ +6H2O
【解析】
B是淡黄色固体,B与化合物A反应产生单质气体C和化合物D,则B是Na2O2,C是O2,G能使红色石蕊试剂变蓝,则G是NH3,NH3与O2在高温下发生反应:4NH3+3O2 ![]() 2N2↑ +6H2O,可知A是H2O,H是N2;D是NaOH;E是一种由两种元素组成的具有耐高温、硬度大的耐热冲击材料,其摩尔质量为 41 g/moL,由于其中一种元素是N元素,N相对原子质量是14,则另一种元素相对原子质量是42-14=27,则另外一种元素是Al元素,E是AlN,NaOH、H2O、AlN发生反应,产生NH3和NaAlO2;则F是NaAlO2,据此解答。
2N2↑ +6H2O,可知A是H2O,H是N2;D是NaOH;E是一种由两种元素组成的具有耐高温、硬度大的耐热冲击材料,其摩尔质量为 41 g/moL,由于其中一种元素是N元素,N相对原子质量是14,则另一种元素相对原子质量是42-14=27,则另外一种元素是Al元素,E是AlN,NaOH、H2O、AlN发生反应,产生NH3和NaAlO2;则F是NaAlO2,据此解答。
根据上述分析可知A是H2O,B是Na2O2,C是O2,D是NaOH,E是AlN,F是NaAlO2。
(1)B是Na2O2,B的电子式为![]() ;
;
(2) E是氮化铝,E的化学式为AlN;
(3)反应②是NaOH、AlN、H2O反应的离子方程式为:AlN+OH- +H2O=AlO2-+NH3 ↑;
(4)反应③是氨气被氧气氧化的反应,该反应的化学方程式是4NH3+3O2 ![]() 2N2↑ +6H2O。
2N2↑ +6H2O。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知Ca2+、OH-、HCO3—的摩尔电导率分别为0.60、1.98、0.45,据此可判断,向饱和的澄清石灰水中通入过量的二氧化碳,溶液导电能力随二氧化碳通入量的变化趋势正确的是( )
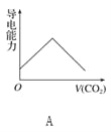
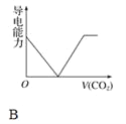

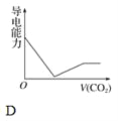
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某实验小组为探究ClO-、I2、SO![]() 在酸性条件下的氧化性强弱,设计实验如下:
在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉-碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4 mL 0.5 mol·L-1的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式:__________________________。
(2)实验②的化学反应中转移电子的物质的量是___________________。
(3)以上实验说明,在酸性条件下ClO-、I2、SO![]() 的氧化性由弱到强的顺序是________________。
的氧化性由弱到强的顺序是________________。
Ⅱ.(4)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是________(填序号)。
A.Cl2 B.H2O2
C.ClO2 D.O3
(5)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是_______________________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Al3+、Fe3+、Cu2+、Ba2+、K+和五种阴离子NO![]() 、OH-、Cl-、CO
、OH-、Cl-、CO![]() 、Xn-(n=1或2)中的一种。
、Xn-(n=1或2)中的一种。
(1)某同学通过比较分析,认为无须检验就可判断其中必有的两种物质是_____和_____。
(2)物质C中含有离子Xn-。为了确定Xn-,现将(1)中的两种物质记为A和B,当C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体,则X为________(填字母)。
A.Br- B.CH3COO- C.SO![]() D.HCO
D.HCO![]()
(3)将38.4 g Cu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,则物质D一定含有上述离子中的________(填相应的离子符号),写出Cu溶解的离子方程式____________________________________________,若要将Cu完全溶解,至少加入H2SO4的物质的量是_____________。
(4)E溶液与氢碘酸反应时可生成使淀粉变蓝的物质,该反应的离子方程式为___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂联合生产等都是很好的“低碳”生产方式。下面是几家工厂利用废气、废液、废渣联合生产化肥硫酸铵的工艺:

请回答下列问题:
(1)操作②为______________________________________________________。
(2)工业合成氨的化学方程式为_____________________。
(3)沉淀池中生成硫酸铵的化学方程式________________________________________。
(4)在实验室中检验氨气的方法是_________________________________。
(5)副产品的化学式为________。该联合生产工艺中可以循环使用的物质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜在生活中有广泛的应用。CuCl2和CuCl是两种常见的盐,广泛应用于工业生产。
I. CuCl2固体遇水易水解。实验室用如图所示的实验仪器及药品来制备纯净、干燥的氯气,并与粗铜(含杂质铁)反应制备氯化铜(铁架台、铁夹及酒精灯省略)。

(1)写出装置A中,发生反应的化学反应方程式:____,装置C的作用是____
(2)完成上述实验,按气流方向连接各仪器接口的顺序是a→___。(每种仪器限使用一次)
(3)上述D装置的作用是____
Ⅱ. CuCl是应用广泛的有机合成催化剂,可采取不同方法制取。CuCl晶体呈白色,露置于潮湿空气中易被氧化。
方法一:向上述制得的氯化铜溶液中通入SO2,加热一段时间即可制得CuCl,写出该反应的离子方程式:___。
方法二:铜粉还原CuSO4溶液
![]()
已知:CuCl难溶于水和乙醇,在水溶液中存在平衡:CuCl(白色)+2Cl-![]() [CuCl3]2-(无色溶液)。
[CuCl3]2-(无色溶液)。
(1)①中,“加热”温度不宜过高和过低,目的是___,当观察到__现象,即表明反应已经完全。
(2)②中,加入大量水的作用是___。(从平衡角度解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机化合物的说法正确的是( )
A. 乙烷与![]() 在光照条件下发生取代反应,最多生成6种氯代烃
在光照条件下发生取代反应,最多生成6种氯代烃
B. 丙烯能分别使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色,二者褪色原理相同
C. 甲苯分子中最多有12个原子共平面
D. 乙醇在不同条件下可被氧化生成二氧化碳、乙醛或乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、SiO32-、SO32-、CO32-、SO42-中的若干种离子,某同学对该溶液进行了如下实验:

下列判断错误的是
A. 气体甲可能是混合物
B. 沉淀甲是硅酸和硅酸镁的混合物
C. 白色沉淀乙的主要成分是氢氧化铝
D. K+、AlO2-和SiO32-一定存在于溶液X中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现以淀粉或乙烯为主要原料都可以合成乙酸乙酯,其合成路线如图所示。

(已知:2CH3CHO+O2![]() 2CH3COOH)
2CH3COOH)
(1)A中含有的官能团名称是______________;其中③的反应类型是______________;
⑥的反应类型是______________;
(2)写乙烯的电子式:_________________乙烯的结构简式:____________;
(3)写出下列反应的化学方程式:①__________________;⑤______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com