
分类是重要的科学研究方法,下列物质归类不正确的是( )
|
| A. | 电解质:明矾、氯气、冰醋酸、硫酸钡 |
|
| B. | 化合物:干冰、烧碱、冰水混合物、胆矾 |
|
| C. | 混合物:铝热剂、矿泉水、水玻璃、漂白粉 |
|
| D. | 同素异形体:C60、C70、金刚石 |
| 单质和化合物;同素异形体;混合物和纯净物;电解质与非电解质. | |
| 专题: | 物质的分类专题. |
| 分析: | A.电解质是水溶液中或熔融状态下能导电的化合物; B.化合物是不同元素组成的纯净物; C.混合物是不同物质组成的物质; D.依据同素异形体概念是同种元素组成的不同单质分析判断. |
| 解答: | 解:A.明矾是盐属于电解质、氯气是单质不是电解质、冰醋酸是弱酸属于电解质、硫酸钡是盐属于电解质,故A错误; B.干冰是二氧化碳、烧碱是氢氧化钠、冰水混合物是水、胆矾是五个结晶水的硫酸铜属于纯净的化合物,故B正确; C.铝热剂是铝和金属氧化物的混合物、矿泉水是电解质的水溶液属于混合物、水玻璃是硅酸钠的水溶液属于混合物、漂白粉主要成分为氯化钙和次氯酸钙,属于混合物,故C正确; D.C60、C70、金刚石都是碳元素组成的纯净物属于单质,结构不同,物理性质不同属于同素异形体,故D正确; 故选A. |
| 点评: | 本题考查了化学概念和物质分类的分析判断,掌握理解概念的本质是解题关键,题目较简单. |


科目:高中化学 来源: 题型:
在120℃条件下,1 mL气态混合物与10 mLO2混合后点燃,最终测得气体的总体积为11 mL。则该气态混合物可能是
A.C2H4、C6H6
B.CH4、CH2O
C.C3H8、CH3CH2OH
D.C2H6、CH3CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学在实验室进行了如图所示的实验,下列说法中错误的是( )
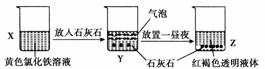
A.利用过滤的方法,可将Z中固体与液体分离
B.X、Z烧杯中分散质相同
C.Y中反应的离子方程式为3CaCO3+2Fe3++3H2O===2Fe(OH)3+3CO2↑+3Ca2+
D.Z中分散系能产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
A由Al2O3、Fe3O4、Al、Cu中的某几种粉末混合而成,设计成分分析方案如下:
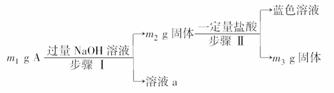
下列分析不正确的是( )
A.当m1>m2时,溶液a中阴离子只有1种
B.生成蓝色溶液的离子方程式为Cu+2Fe3+===Cu2++2Fe2+
C.要确定混合物中是否含Al,可取A加入适量稀HCl
D.当m2-m3=2.96 g,Fe3O4的质量至少为2.32 g
查看答案和解析>>
科目:高中化学 来源: 题型:
Hagemann酯(H)是一种合成多环化合物的中间体,可由下列路线合成(部分反应条件略去):
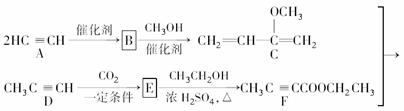

(1)A→B为加成反应,则B的结构简式是________;B→C的反应类型是________。
(2)H中含有的官能团名称是________;F的名称(系统命名)是________。
(3)E→F的化学方程式是____________________________________________。
(4)TMOB是H的同分异构体,具有下列结构特征:
①核磁共振氢谱除苯环吸收峰外仅有1个吸收峰;
②存在甲氧基(CH3O—)。TMOB的结构简式是________。
(5)下列说法正确的是________。
a.A能和HCl反应得到聚氯乙烯的单体
b.D和F中均含有2个π键
c.1 mol G完全燃烧生成7 mol H2O
d.H能发生加成、取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
北京奥运会期间对大量盆栽鲜花施用了S﹣诱抗素制剂,以保证鲜花盛开,S﹣诱抗素的分子结构如图,下列关于该分子说法正确的是( )
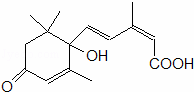
|
| A. | 含有碳碳双键、羟基、羰基、羧基 |
|
| B. | 含有苯环、羟基、羰基、羧基 |
|
| C. | 含有羟基、羰基、羧基、酯基 |
|
| D. | 含有碳碳双键、苯环、羟基、羰基 |
查看答案和解析>>
科目:高中化学 来源: 题型:
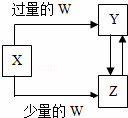
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )
| 选项 | W | X |
| A | 盐酸 | Na2CO3溶液 |
| B | Cl2 | Fe |
| C | CO2 | Ca(OH)2溶液 |
| D | NaOH溶液 | AlCl3溶液 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
以苯酚为原料合成  的路线如下所示.请按要求作答:
的路线如下所示.请按要求作答:

(1)写出以下物质的结构简式:B ,F .
(2)写出反应④、⑤的化学反应方程式:④ ⑤
(3)反应⑤可以得到E,同时可能得到的副产物的结构简式为, .
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体的是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。
利用下图所示装置进行实验。
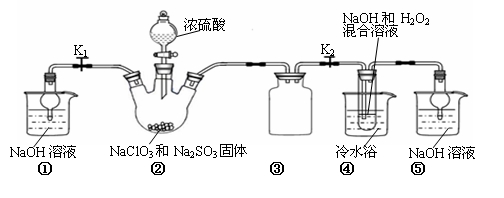
(1)装置①的作用是 装置③的作用是 。
(2)装置②中产生ClO2的化学方程式为 。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③ ;④低于60℃干燥,得到成品。
(4)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作与现象是:取少量晶体溶于蒸馏水, 。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用c mol•L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
(5)滴定中使用的指示剂是 ,达到滴定终点时的现象为 。
(6)样品中NaClO2的质量分数为 (用含m、c、V的代数式表示,式量:NaClO2 90.5)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com